|
||||

Анализ методов взятия крови у экспериментальных крысУДК 616-072.5:599.323.45 Душенина О.А., Карпенко Л.Ю., Васильева С.В. Федеральное государственное бюджетное образовательное Крысы - наиболее часто используемый вид животных для различных экспериментов, особенно при проведении доклинических исследований [1]. Это обусловлено определенными факторами, например, высокой плодовитостью, неприхотливостью и дешевизной в содержании по сравнению с другими лабораторными животными. При оценке результатов эксперимента используют большое количество показателей состояния организма крыс, включая исследование крови. Биохимический анализ позволяет провести мониторинг практически всех видов обмена веществ - белкового, углеводного, липидного, минерального, а также выявить нарушение функций различных органов и систем [4]. В рамках доклинических исследований обычно определяют такие показатели сыворотки или плазмы крови, как глюкоза, общий белок, альбумин, АЛТ, АСТ, креатинин, мочевина, а также некоторые маркеры повреждения печени -щелочная фосфатаза, желчные кислоты, гамма-глутамилтрансфераза. И для исследования всех перечисленных биохимических маркеров подходит не только сыворотка, но и плазма крови [6]. Гематологическое исследование позволяет выявить реакцию на воспалительный процесс, оценить адаптационные способности организма в целом, а также состояние дыхательной функции крови. Всё это чрезвычайно важно для испытания различных лекарственных средств, кормовых добавок, биопрепаратов, влияние которых на организм исследуется в рамках научных экспериментов. Необходимо отметить важность преаналитического этапа в проведении лабораторных исследований: допускаемые в рамках данного этапа ошибки могут свести на нет огромную работу по постановке эксперимента [2]. В этой связи немаловажной проблемой является забор крови у лабораторных животных малого размера. При всех очевидных преимуществах в использовании крыс в качестве экспериментальных моделей, болевой точкой является именно сложность взятия у них крови [10]. Как известно, для гематологического анализа требуется не менее 500 мкл цельной крови, а для биохимического исследования - не менее 100 мкл сыворотки или плазмы [8], в зависимости от перечня исследуемых показателей необходимый объём может быть увеличен. Таким образом, для проведения полноценного исследования необходимо получить не менее 1 мл крови от одного животного. Поэтому крыс часто используют в рамках острого опыта, то есть забор крови проводят с их умерщвлением (как правило с декапитацией). Однако более гуманным по отношению к лабораторным животным было бы проведение хронического эксперимента с многократным забором крови без существенной травматизации [9]. Перед началом эксперимента нами были рассмотрены и проанализированы наиболее распространенные из существующих методов забора крови. Одним из них является метод забора крови с применением анестезии, однако использование данного способа существенно влияет на показатели крови, и как следствие, на результаты исследований [7]. К методам взятия крови, требующим применение наркоза, относится ампутация кончика хвоста. Недостатком данного метода является тот факт, что при повторных взятиях крови увеличивается число лейкоцитов из-за развития воспаления и анестезия также будет отражаться на показателях крови [5]. При взятии крови из ретробульбарного синуса возникает риск получить травму глаза, также в кровь может попасть слезная жидкость, что влияет на результаты эксперимента. При пункции сердца удается получить достаточно большой объем крови - до 5 мл, но данный метод может привести к гибели животного [11]. Также существует терминальный (тотальный) метод забора крови, при котором происходит полное обескровливание животного, например, с помощью декапитации [3]. Однако, данный способ не соответствует конечной цели эксперимента, которая направлена на поиск максимально гуманных и безвредных способов. К методам, не требующим наркоза, также относятся взятие крови из ушных раковин или прокол подушечки лапы крысы, но при данном способе исследователям удавалось получить чрезвычайно малое количество крови, тогда как повторные заборы возможны были только через 3-5 дней. При взятии крови из десны возникал большой риск попадания в кровь слюны, остатков пищи и микрофлоры ротовой полости, что влияло на результаты опыта. При заборе крови из хвоста использовался циркулярный надрез хвостовой вены на глубину 1-2 мм, но данный метод давал возможность получить малые объемы крови. Также существенным минусом данного способа является риск травмирования нерва, который проходит рядом с веной и может способствовать образованию трофических язв и участков некроза. На сегодняшний день известен и способ забора крови из каудальной хвостовой вены с помощью венепункции. Использование данного метода позволяет получать кровь без излишней травматизации тканей и подходит для хронического опыта с многократным отбором проб. Ещё одной дилеммой является использование антикоагулянта при взятии крови. Ввиду того, что у крыс можно получить достаточно малые объёмы крови, очень актуально использовать антикоагулянты не только для гематологических, но и для биохимических исследований, так как при центрифугировании выход плазмы на 15-20% выше, чем сыворотки из того же объёма крови [4]. Считается, что оптимальным стабилизатором крови для гематологических анализов является ЭДТА, так как он препятствует агрегации тромбоцитов и лейкоцитов, что очень важно для аппаратных методов исследования крови. Однако этот антикоагулянт, так же, как и цитрат натрия подходит далеко не для всех биохимических анализов, так как взаимодействуют с двухвалентными макро- и микроэлементами (кальций, магний, железо, медь, цинк и др.), образуя с ними соли, что существенно занижает результаты их исследования. По этой причине их нельзя использовать для исследования активности щелочной фосфатазы, так как это цинксодержащий фермент. По данным различных методических пособий по биохимическим исследованиям [4] менее всего искажает результаты гепарин. Гепаринизированная кровь вполне подходит и для гематологического исследования ручным методом. Также промывание иглы для венепункции раствором антикоагулянта значительно снижает риск закупорки её просвета сгустком крови. Целью наших исследований стал сравнительный анализ эффективности забора крови у крыс с помощью иглы инъекционной и катетера-бабочки с размером 24G с использованием антикоагулянта. Материалы и методы исследований. Опыт проводился на лабораторных белых крысах линии Wistar (самцы, 10 голов) массой 209-228 г. Было сформировано 2 группы животных по 5 особей. У животных первой группы отбирали кровь с помощью катетера-бабочки, подсоединённого к шприцу на 2 мл, у второй группы - с помощью инъекционной иглы самотёком в пробирку «Эппендорф» на 2 мл. Также в работе использовались жгут, гепарин (5 000 ЕД/мл), физиологический раствор. Параметрические размеры иглы инъекционной и катетера-бабоч ки представлены в таблице 1. Таблица 1 Параметры применяемых в эксперименте игл для венепункции
Для стабилизации крови использовался гепарин в разведении 1:10 с физиологическим раствором (в рабочем растворе 500 ЕД/мл гепарина). Перед взятием крови подготавливали шприцы, иглы, катетеры-бабочки и пробирки «Эппендорф». Для крыс первой группы перед забором крови к шприцу подсоединяли катетер-бабочку и насасывали около 1 мл рабочего раствора гепарина, после чего шприц и катетер опорожняли от жидкости, оставляя в катетере приблизительно 0,05 мл раствора. Таким же образом готовили шприцы с иглами для второй группы крыс, но раствор гепарина в минимальном количестве (не более 0,1 мл) оставляли в самом шприце. Кроме того, этим же раствором предварительно ополаскивали пробирки «Эппендорф». Перед взятием крови хвост опускали в теплую воду при температуре 35-40°С приблизительно на две минуты. Затем хвост вытирали сухой салфеткой, перетягивали тонким резиновым жгутом у основания и фиксировали животное путём оборачивания туловища в плотную ткань. Место инъекции обрабатывали этиловым спиртом и проводили венепункцию. Крысам первой группы вводили в хвостовую вену иглу- бабочку, соединённую со шприцем, и аккуратно насасывали кровь, создавая небольшое отрицательное давление, во избежание разрушения форменных элементов. Крысам второй группы в хвостовую вену вводили инъекционную иглу и к канюле подставляли пробирку «Эппендорф» для сбора крови самотёком. Измерение объёма каждой пробы крови проводили методом аликвотирования с применением автоматических дозаторов переменного объёма «Biohit». Результаты исследований и их обсуждение. Результаты исследования объема полученной крови представлены в таблице 2. Таблица 2 Результаты исследования количества крови
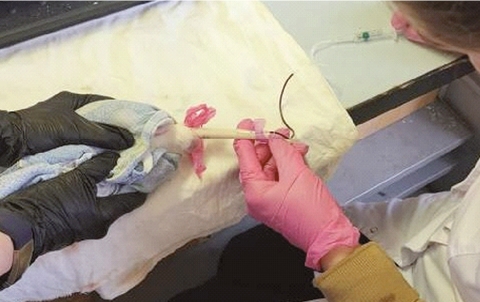
По результатам, представленным в таблице 2, можно отметить достоверное различие в полученном объёме крови при межгрупповом сравнении практически в четыре раза (P<0,01). При этом во второй группе у некоторых крыс получены достаточно малые объёмы крови, которые с учётом количества применяемого антикоагулянта могут иметь искажение результатов ввиду некорректного разведения. При взятии крови более эргономичным и технически удобным методом явилось применение катетера-бабочки. В этом случае достаточно участие двух человек, один из которых осуществляет фиксацию животного, а другой - непосредственно забор крови. После введения иглы в вену левой рукой фиксируется игла путём прижатия пластиковых «крыльев» к хвосту и одновременно поддерживается хвост в стационарном положении. Правой рукой производится плавное отжатие поршня шприца (рисунок 1).
Рис. 1. Взятие крови из хвостовой вены с помощью катетера-бабочки Использование иглы инъекционной оказалось менее эргономичным, что в первую очередь, связано с длиной самой иглы (25 мм) и наличием канюли, которая ограничивает манёвренность при взятии крови, а также способствует прокалыванию вены насквозь при случайном толчке животного во время процедуры. Всё это осложняет данный процесс и приводит к потере или недополучению крови (рисунок 2).
Рис. 2. Взятие крови из хвостовой вены с помощью инъекционной иглы Также, по нашим наблюдениям, отсутствие отрицательного давления приводило к замедлению кровотока из инъекционной иглы и преждевременной остановке крови, ввиду чего получали меньшие объёмы крови в сравнении с методом, в котором использовался катетер-бабочка, соединённый со шприцем. Была проведена визуальная оценка и определение количества плазмы крови, полученной при центрифугировании проб первой группы. Для отделения плазмы использовали мини-центрифугу марки «FVL-2400N», время центрифугирования - 10 минут. В таблице 3 представлены данные по объёму плазмы крови во всех пробах, что подтверждает целесообразность забора крови с предварительным промыванием системы антикоагулянтом. Таблица 3 Результаты исследования объёма плазмы из гепаринизированной крови
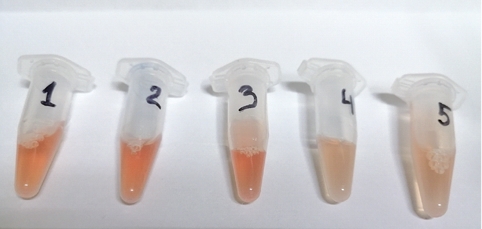
Визуальная оценка плазмы показала отсутствие видимых глазом признаков гемолиза (рисунок 3 и 4). Это подтверждает целесообразность взятия крови у крыс путём насасывания шприцем и с применением иглы-катетера.
Рис. 3. Визуальная оценка плазмы крови после центрифугирования
Рис. 4. Вид плазмы, отделённой от крови после центрифугирования Объём полученной плазмы (370-760 мкл) вполне позволяет проводить обширное биохимическое исследование у лабораторных крыс. На основании проведённых исследований можно сделать следующие выводы: 1. Взятие крови из хвостовой вены у лабораторных крыс с помощью катетера-бабочки 24G, подсоединённой к шприцу, продемонстрировало техническое удобство и эргономичность в сравнении с применением инъекционной иглы аналогичного размера для получения крови самотёком. 2. Применение катетера-бабочки способствует значительному увеличению объёма отбираемой крови (в четырёхкратном размере) в сравнении с венепункцией инъекционной иглой. 3. Использование раствора гепарина 500 ЕД/мл для предварительного промывания шприца и катетера целесообразно для получения от лабораторных крыс гепаринизированной плазмы без следов гемолиза в количестве, достаточном для дальнейшего биохимического исследования (150-540 мкл). Заключение. При использовании метода забора крови у крыс с применением катетера-бабочки и шприца, обработанных раствором гепарина, можно получать достоверные результаты, которые позволят сделать более точные выводы об итогах исследования. Важным является возможность многократного взятия крови у лабораторных крыс в условиях хронического опыта. Нами установлено, что метод взятия крови из хвостовой вены у лабораторных крыс с помощью катетера-бабочки 24G, подсоединённой к шприцу, наименее трудоемкий и не вызывает травматизацию экспериментальных животных. Полученные в рамках данного исследования результаты будут способствовать оптимизации научно-исследовательской работы в вивариях и могут быть использованы при выполнении экспериментов в рамках диссертационных работ. Список литературы: 1. Васильев А.Н. Качественные доклинические исследования - необходимый этап разработки и внедрения в клиническую практику новых лекарственных препаратов// Антибиотики и химиотерапия. 2012. Т. 57. № 1-2. С. 41-49. EDN QCRZIE. 2. Иванова Л.А., Хайдуков С.В., Серебровская Л.В. Особенности преана-литического этапа для иммунофенотипирования клеток периферической крови// Медицинская иммунология. 2011. Т. 13. № 6. С. 639-646. EDN NXLPLL. 3. Карпенко Л.Ю., Козицына А.И., Полистовская П.А. Особенности показателей белой крови при хроническом респираторном синдроме крыс// Вопросы нормативно-правового регулирования в ветеринарии. 2021. № 1. С. 120122. DOI 10.17238/issn2072-6023.2021.1.120. EDN VDWOWE. 4. Клиническая лабораторная диагностика: учебник в двух томах/ А.В. Бугров, В.В. Долгов, С.П. Казаков [и др.]// ООО «Лабдиаг». 2017. 464 с. ISBN 978-5-7249-2608-9. EDN URDNDP. 5. Метод забора крови у животных/ А.В. Дьякон, И.С. Хрыкина, А.А. Хегай [и др.]// Международный журнал прикладных и фундаментальных исследований. 2013. № 11-2. С. 84-85. EDN RHDLEH. 6. Опыт проведения клинико-лабораторных исследований в доклинической оценке безопасности лекарств (часть 2: биохимические и патоморфологи-ческие исследования)/ А.В. Сорокина, С.В. Алексеева, Н.В. Еремина [и др.]// Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2019. Т. 9. № 4. С. 272-279. DOI 10.30895/1991-2919-2019-9-4-272-279. EDN CJPNXU. 7. Петренко Н.И., Тимкин П.Д., Кропотова М.Е. Способ забора крови у крыс из периферических вен хвоста// Патент № 2719912 C1 Российская Федерация, МПК G09B 23/28. EDN LVYBIC. 8. Соснин Д.Ю., Ненашева О.Ю. Автоматизация преаналитического этапа гематологических исследований// Справочник заведующего КДЛ. 2012. № 12. С. 35-46. EDN QBPBZB. 9. Шатненко О.А. Анализ ошибок преаналитического этапа в централизованной лаборатории второго уровня// Лабораторная служба. 2016. Т. 5. № 3. С. 26. EDN XRLQON. 10. Янченко О.С., Конторщикова К.Н. Преаналитические аспекты гематологического исследования// Медицинский альманах. 2016. № 2 (42). С. 2629. EDN TUHBUY. 11. Taraskin A., Bakhta A., Karpenko L. et al. Blood biochemical markers in Saanen goats depending on month of pregnancy// FASEB Journal. 2021. Vol. 35. No. S1. P. 05198. DOI 10.1096/fasebj.2021.35.S1.05198. EDN JSVGFR. Резюме. Крысы - это животные, которые наиболее часто используются в лабораторных исследованиях, особенно при проведении доклинических исследований. Это обусловлено определенными факторами, например, высокой плодовитостью, неприхотливостью и дешевизной в содержании по сравнению с другими лабораторными животными. При оценке результатов опыта одним из главных показателей является исследование крови. Однако взятие крови у мелких лабораторных животных связано с большим количеством трудностей. В статье представлены данные по сравнению эффективности забора крови у крыс с помощью иглы инъекционной и катетера-бабочки размером G-24 с применением гепарина в качестве антикоагулянта. При использовании метода забора крови у крыс с применением катетера-бабочки и шприца, обработанных раствором гепарина, можно получать достоверные результаты, которые позволят сделать более точные выводы об итогах исследования. Важным является возможность многократного взятия крови у лабораторных крыс в условиях хронического опыта. Установлено, что использование катетера-бабочки размером G-24 позволяет отобрать наибольшее количество крови (до 2 мл) и избежать разрушения форменных элементов. Применение в практике данного метода актуализирует многократный забор крови у крыс в хроническом эксперименте, уменьшает трудоемкость процесса взятия крови и минимизирует травматизацию лабораторных животных. Использование раствора гепарина 500 ЕД/мл для предварительного промывания шприца и катетера целесообразно для получения от лабораторных крыс гепаринизированной плазмы без следов гемолиза в количестве, достаточном для дальнейшего биохимического исследования (150-540 мкл). Полученные в рамках данного исследования результаты будут способствовать оптимизации научно-исследовательской работы в вивариях и могут быть использованы при выполнении экспериментов в рамках диссертационных работ. Ключевые слова: кровь, плазма, гепарин, инъекционный шприц, катетер-бабочка, крысы, декапитация, наркоз, венопункция, хвостовая вена. Сведения об авторах: Карпенко Лариса Юрьевна, доктор биологических наук, профессор, заведующий кафедрой биохимии и физиологии ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-9981291; e-mail: l.u.karpenko@mail.ru. Васильева Светлана Владимировна, кандидат ветеринарных наук, доцент кафедры биохимии и физиологии ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-904-6399033; e-mail: svvet@mail.ru. Ответственный за переписку с редакцией: Душенина Ольга Александровна, кандидат биологических наук, доцент кафедры биохимии и физиологии ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084 г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-905-2693736; e-mail: olgpanchenkova@yandex.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|