|
||||

Новые штаммы Lactobacillus Acidophilus как перспективные пробиотики для птицеводстваУДК 579.64 Валиуллин Л.Р. Федеральное государственное бюджетное научное учреждение «Всероссийский Птицеводство является основной составляющей сельского хозяйства, наиболее динамичной и наукоемкой отраслью агропромышленного комплекса, обеспечивающей население Российской Федерации широким ассортиментом продуктов с диетическими (лечебными) свойствами [11, 12]. В решении актуальной проблемы обеспечения продовольственной безопасности страны значимость данной отрасли колоссальна в связи с промышленным производством полноценной сбалансированной продукции [11]. В условиях птицеводческих предприятий на организм молодняка сельскохозяйственной птицы оказывает воздействие ряд неблагоприятных факторов, которые способны приводить к изменениям состава микробиоты кишечника в сторону повышения уровня условно-патогенных микроорганизмов, к нарушениям функционирования различных органов и систем организма и, таким образом, к резкому снижению его естественной резистентности [3, 24]. Наиболее перспективным подходом восстановления уровня и оптимизации функции микробиоты кишечника птицы является применение биопрепаратов микробного происхождения - пробиотических добавок [4, 15, 26]. Накопленные к настоящему времени результаты исследований российских и зарубежных авторов свидетельствуют о том, что микроорганизмы с пробиотическими свойствами проявляют комплексные свойства: обладают антагонистическим потенциалом в отношении патогенных и условно-патогенных микроорганизмов образованием пероксида водорода, органических кислот (уксусной, янтарной, молочной, муравьиной) антибиотических веществ, лизоцима и бактериоцинов, а также конкуренцией за рецепторные структуры, питательные субстраты и места обитания (механизм конкурентного исключения); играют роль в процессе пищеварения путем продукции гидролаз (амилаз, протеаз и липаз) - аналогов пищеварительных ферментов макроорганизма; синтезируют разнообразный набор биологически активных веществ (витамины, аминокислоты, пептиды, полисахариды, ферменты), обладающих адъювантными, иммуномодулирующими, антиоксидантными и детоксикационное действиями; способствуют выведению токсичных для организма тяжелых металлов (стронция, серебра, кадмия) [9, 16, 29]. В связи с тем, что большинство установленных к настоящему времени пробиотических штаммов являются представителями облигатной микробиоты кишечника млекопитающих, преобладают в ней по численности и физиологической важности, добавки на их основе считаются безопасными и используются без ограничения в сельском хозяйстве [4, 12]. К микроорганизмам, используемым как основа пробиотиков, относят штаммы бифидобактерий, лактобактерий, пропионибактерий, споровых аэробных бацилл, дрожжевых грибов, энтерококков, термофильных стрептококков и индигенных эшерихий [3, 6, 28]. Правильный выбор пробиотических микроорганизмов необходим в связи с получением оптимальных эффектов, которые значимы для улучшения питания и охраны здоровья сельскохозяйственных животных. В этом плане к числу наиболее перспективных объектов относятся штаммы бактерий вида Lactobacillus acidophilus [8, 24]. Установлена способность некоторых штаммов данного вида выживать в условиях, имитирующих желудочную среду (с pH 2.0 в течение 90 мин) [7]. Показано, что они образуют органические кислоты (лактат), витамины (РР, В3, В5, В6, B9 и В12), антибиотики и бактериоцины (ацидоцин, ацидофилин, лактоцидин, лактоцин) [7, 8, 27]. В последние годы за рубежом начали появляться сведения, что штаммы вида L. acidophilus продуцируют различные внеклеточные ферменты гидролитического действия (целлюлазы и амилазы), способные принимать участие в модулировании кишечной микробиоты сельскохозяйственных птиц [20]. Тем не менее, исследования, направленные на комплексный анализ активности данного класса ферментов штаммов L. acidophilus с пробиотическими свойствами, отсутствуют. Кроме того, установлено, что они проявляют лечебнопрофилактический и ростостимулирующий эффект на цыплят-бройлеров [21, 24]. Необходимость дальнейшего исследования в этом направлении не подлежит сомнению для разработки новых средств на основе микробных штаммов и их биологически активных соединений, а также энзимно-пробиотических комплексов. Цель исследований - оценка пробиотических свойств новых штаммов L. acidophilus in vitro для возможности их использования в птицеводстве. Материалы и методы исследований. Материалами для исследований служили полученные из фонда Коллекции микроорганизмов Всероссийского научно-исследовательского института фитопатологии (Московская обл., Россия) 6 штаммов L. acidophilus. Для выращивания лактобактерий применяли стерильное обезжиренное молоко или MRS среду (Conda, Испания). В качестве тест-объектов использовали грамположительные (Staphylococcus aureus, Enterococcus sp.) и грамотрицательные (Escherichia coli, Pseudomonas aeruginosa, Salmonella sp.) микроорганизмы, изолированные из биоматериала погибших цыплят с клиническими симптомами кишечных инфекций. Оценку in vitro антагонистических свойств штаммов лактобактерий в отношении тест-микроорганизмов проводили методом, который изложен в работе Nachi et al. (2019) [22]. Способность исследуемых микроорганизмов к росту при различных температурах устанавливали культивированием их в агаризо-ванной среде MRS при 15 и 45°С в течение 48 ч [6]. Способность бактериальных штаммов к росту в условиях различной концентрации водородных ионов или солености оценивали инкубированием их на вышеуказанной питательной среде с рН 4,0 и рН 9,0 или содержанием хлористого натрия 4 и 6,5 % при 37°С в течение 48 ч. [18]. Исследование каталазной активности лактобацилл, выращенных на жидкой (стерильное молоко) питательной среде в течение 48 ч, проводили по ГОСТ Р 56139-2014. Для этого 150 мкл нейтрализованной 10%-ным раствором гидроокиси натрия культуральной жидкости выдерживали на воздухе в течение 30 мин и вносили к ней каплю 5 мкл 3%-ного раствора перекиси водорода. По образованию пузырьков кислорода при воздействии на клетки культуры перекиси водорода судили о споУстойчивость лактобацилл к желчи оценивали in vitro методом, описанным в работе Хадиева и др. (2006) [10]. Для исследования применяли желчь цыплят-бройлеров, стерилизованную путем фильтрования через мембранный фильтр Millex (d пор 0,22 мкм, Millipore, Германия). Бактериальные клетки штаммов получали после их культивирования в бульонах типа Мозера-Рогоза-Шарпа (HiMedia, Индия) в течение 2 суток методом центрифугирования при 10000 об./мин в течение 15 мин. Начальный титр активных клеток для штамма L. acidophilus IV8 составил 2,60*109 КОЕ/мл, для штамма L. acidophilus IV72 - 5,14*109 КОЕ/мл. Клетки лактобацилл вносили в среду MRS, содержащей 1% или 5% желчь, и инкубировали при 37°С в течение 6 ч. Затем отбирали 0,1 мл суспензии, готовили серию ее разведений в 0,1% растворе пептона и высевали газоном на среду MRS для подсчета количества вегетативных клеток (КОЕ/мл). Инкубацию посевов вели при 37°C в течение 48 ч. Устойчивость лактобацилл к рН и имитацию транзита лактобацилл через желудочно-кишечный тракт сельскохозяйственных птиц in vitro проводили в среде MRS при значениях рН 5.0, 3.0 и 7.0 (соответствует зобу, желудку и кишечнику) и длительности инкубации при 40°С от 60 до 150 мин. Начальный титр активных клеток для штамма L.acidophilus IV8 - 2,60*109 КОЕ/мл, для штамма L. acidophilus IV72 - 5,14*109 КОЕ/мл [10]. Бактериальные клетки исследуемых штаммов выдерживали в бульоне типа Мозера-Рогоза-Шарпа c рН 5.0 в течение 60 мин, концентрировали методом центрифугирования (10000 об./мин в течение 15 мин), осадок суспензировали в таком же объеме свежей среды MRS с рН 3.0 и инкубировали в течение 90 мин. После чего отбирали 0,1 мл клеточной суспензии, готовили серию ее разведений в 0,1 % (масса/объем) растворе пептона и высевали на вышеуказанную агаризованную среду для подсчета КОЕ/мл. Оставшуюся суспензию клеток осаждали путем центрифугирования и переносили в среду MRS с рН 7.0. Инкубацию проводили в течение 150 мин. Аликвоту объемом 0,1 мл отбирали для установления количества вегетативных клеток (КОЕ/мл). Для культивирования исследуемых бактериальных штаммов при оценке их способности к продукции внеклеточные гидролаз использовали жидкую модифицированную среду MRS, содержащей в качестве источников питания соответствующие ферментам индукторы их синтеза (карбоксиметилцеллюлоза, ксилан, крахмал и казеин в концентрации 1,0%, дикалиевая соль фитиновой кислоты - 0,1% и оливковое масло - 2,0%). Штаммы бактерий выращивали при температуре 37°С в течение суток. Аликвоты культурального супернатанта, используемого в качестве источника ферментов, получали из культуральной жидкости лактобацилл методом ее центрифугирования при 10 тыс. об/мин в течение 10 мин для оценки гидролазной активности [2]. Активность целлюлазы, ксиланазы и амилазы в культуральных супернатантах бактериальных штаммов устанавливали калориметрическим способом, который основан на определении содержания редуцирующих сахаров после разложения соответствующего субстрата ферментами, с помощью реагента ДНСК (3,5-динитросалициловая кислота), в соответствии с методиками, описанными нами ранее [2, 13, 14] и в работах зарубежных авторов [20]. За 1 единицу активности гидролазы принимали определенное количество фермента, приводящей к образованию 1 мкмоля восстанавливающих сахаров (в эквиваленте соответствующего моносахарида) за 1 мин реакции в 1 мл реакционной смеси в условиях экспериментального исследования. Активность протеазы лактобацилл оценивали методом, описанным в работе Oke и Onilude (2014) [23]. В качестве субстрата использовали 2% раствор казеина, приготовленный в фосфатно-цит-ратном буферном растворе (0,1 М, рН 5,5). Реакционную смесь, содержащей культуральный супернатант (1 мл) и раствор субстрата (1 мл), инкубировали при 28°С в течение 20 мин, вносили 10% трихлоруксусную кислоту (3 мл) и выдерживали при 4°С в течение 60 мин. Измерение оптической плотности осуществляли при длине волны 660 нм. Активность фермента выражали в международных единицах. Активность фитазы в культуральных супернатантах бактериальных штаммов устанавливали по методу Tang et al. (2010), используя в качестве субстрата фитат натрия [25]. Реакционная смесь состояла из 10 мМ раствора субстрата (400 мкл) в Na-ацетатном буфере (0,1 М, pH 5,5) и раствора фермента (200 мкл). После инкубации при 50°С в течение 30 мин реакцию останавливали добавлением 100 мкл 20% раствора трихлоруксусной кислоты. Измерение оптической плотности осуществляли при длине световой волны 405 нм. За 1 единицу активности фитазы принимали количество фермента, которое необходимо для образования 1 мкМ неорганического фосфата за 60 мин на 1 мл ферментного раствора в условиях эксперимента. Активность липазы лактобацилл оценивали титриметрическим способом, основанным на анализе количества жирных кислот, образовавшихся в результате гидролиза ферментом субстрата 40% эмульсии оливкового масла [17]. Приготовление раствора субстрата осуществляли смешением раствора оливкового масла (100 мл) и 2% раствора поливинилового спирта (150 мл). Реакционная смесь содержала 40% раствора субстрата (5 мл), фосфатного буферного раствора (20 мМ, рН 5,0) (5 мл) и неочищенного фермента (1 мл). Инкубацию смеси вели при 37°С в течение 10 мин. Реакцию останавливали внесением раствора этанола (15 мл), титрацию осуществляли раствором NaOH (0,1 М) в присутствии 1% раствора фенолфталеина в качестве индикатора. За 1 единицу активности липазы принимали количество фермента, которое необходимо для образования 1 мкмоль олеиновой кислоты за 1 мин реакции в опытных условиях. Результаты исследований и их обсуждение. На промышленных птицеводческих предприятиях Российской Федерации у молодняка сельскохозяйственной птицы широко распространены микроэкологи-ческие нарушения кишечника с преобладанием в нем условно-патогенных и патогенных микроорганизмов рода Escherichia, Pseudomonas, Staphylococcus, Salmonella и Enterococcus [12]. В связи с этим, на первом этапе наших исследований определяли способность изучаемых бактериальных штаммов к подавлению роста Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Salmonella sp. и Enterococcus sp. Сравнительная оценка 6 штаммов L. acidophilus показала выраженные различия в уровне и спектре их антимикробного эффекта в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы. По степени ингибирования рост тест-мик-роорганизмов изучаемые нами лактобактерии были разделены на 3 основные группы: с отсутствующей или низкой (зоны угнетения роста до 6 мм), средней (от 6 до 12 мм) и более высокой (более 12 мм) антагонистической активностью. Установлено, что штаммы L. acidophilus IV15, L. acidophilus IV29 и L. acidophilus IV144 обладали умеренной способностью подавлять рост S. aureus, Salmonella sp. и Enterococcus sp. (табл. 1). Таблица 1 Антагонистический потенциал некоторых штаммов молочнокислых бактерий
Примечание: степень проявления антимикробного эффекта: (+) - зона угнетения роста до 6 мм; (++) - от 6 до 12 мм; (+++) - более 12 мм Проявление антагонистической активности L. acidophilus преимущественно обусловлена их способностью к продукции органических кислот, лизоцима и антибиотических соединений, включая бактериоци-нов [8, 18]. К перспективным микроорганизмам для потенциального применения с целью профилактики и лечения кишечных инфекций молодняка сельскохозяйственной птицы отнесены штаммы L. acidophilus IV8 и L. acidophilus IV72. В таблице 2 представлены основные физиолого-биохимические характеристики отобранных штаммов, которые используются при видовой идентификации лактобактерий и входят в требования, предъявляемых к микроорганизмам - основам пробиотиков. Таблица 2 Основные физиолого-биохимические особенности штаммов L. acidophilus
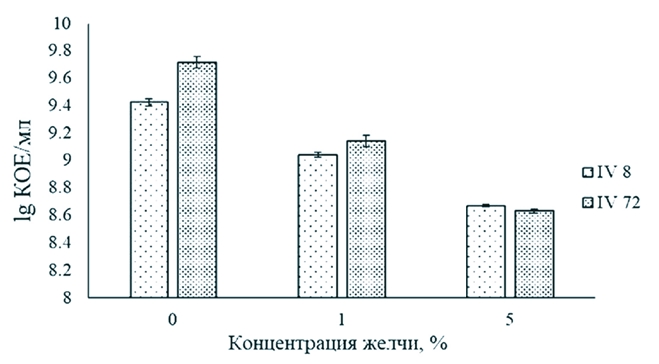
Примечание: (-) - отсутствие признака (+) - наличие принака Одним из основных свойств пробиотиков в плане их практического использования как кормовых добавок в птицеводстве является их устойчивость к кислотам и желчи желудочно-кишечного тракта животных. Выдерживание бактериальных клеток L. acidophilus IV8 и L. acidophilus IV72 (2,60x109 и 5,14*109 КОЕ/мл, соответственно) в жидкой среде MRS, содержащей 1 и 5 % желчи цыплят-бройлеров, в течение 6 ч показало их устойчивость (рисунок 1). В среде с 1% желчью выживаемость штаммов L. acidophilus IV8 и L. acidophilus IV72 составила соответственно 41,9 и 26,3%, в присутствии 5% желчи -18,0 и 8,4% относительно контроля (числа микроорганизмов на единицу объема суспензии в начале эксперимента) (р<0,05).
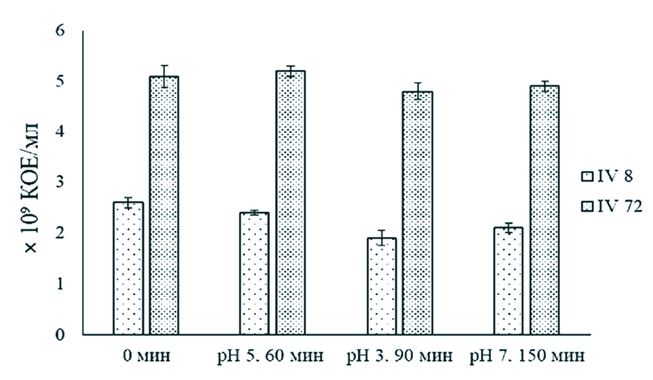
Рис. 1. Устойчивость штаммов L. acidophilus IV8 и L. acidophilus IV72 к желчи цыплят-бройлеров (различия между вариантами статистически значимы (p<0,05) Необходимо отметить, что исследованная концентрация желчи 5% для установления устойчивости изучаемых лактобацилл была существенно выше, чем принято при определении выживаемости бактериальных штаммов, используемых в качестве пробиотиков. Для оценки выживаемости пробиотических штаммов лактобацилл применяют среды с содержанием солей желчи 0,1-0,5% [18]. Результаты нашего исследования согласуются с данными зарубежных авторов, которые установили, что штаммы L. acidophilus значительно различаются по проявлению устойчивости к данному фактору. Так, выживаемость штамма L. acidophilus TISTR1338 после его инкубирования в среде, содержащей 1% соли желчи, в течение 1 ч составила 42,3% относительно контроля [30]. Показана способность некоторых штаммов L. acidophilus, например, L. acidophilus KCTC3140, L. acidophilus KCTC3146 и L. acidophilus KCTC3154, которые изолированы соответственно из крысы, свиньи и курицы, проявлять достаточно высокую устойчивость к различным концентрациям желчи (1-5%) в отличие от выделенного из биоматериала человека штамма L. acidophilus KCTC3179, выживаемость которого после 2 ч воздействия 5% желчи составила 0,65% по сравнению с количеством бактериальных клеток в начале эксперимента [19]. Накопленные к настоящему времени данные исследований российских и зарубежных авторов, свидетельствуют, что в процессе прохождения пробиотических штаммов по желудочно-кишечному тракту сельскохозяйственных животных кислотность способна оказывать значительное воздействие на их выживаемость [7, 19, 29]. Определение устойчивости исследуемых штаммов лактобацилл в средах с приближенными значениями рН к условиям различных отделов пищеварительного тракта птицы показало несущественное снижение количества жизнеспособных бактериальных клеток относительно контроля (числа микроорганизмов на единицу объема суспензии в начале эксперимента) (рисунок 2).
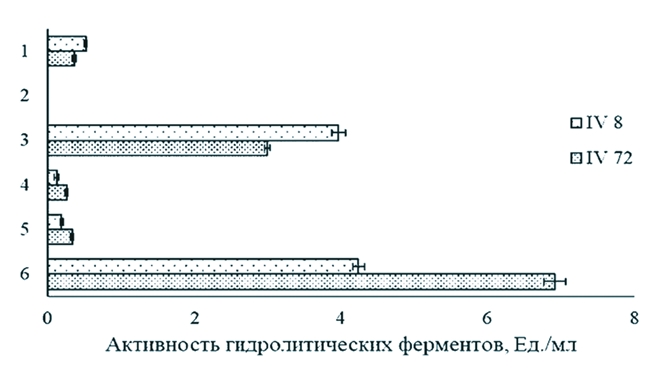
Рис. 2. Устойчивость штаммов L. acidophilus IV8 и L. acidophilus IV72 в средах, значения рН которой аналогичны к условиям в различных отделах пищеварительного тракта сельскохозяйственных птиц (различия между значениями количества жизнеспособных бактериальных клеток L. acidophilus IV72 в условиях, имитирующих их транзит через отделы желудочно-кишечного тракта животных, не значимы (р>0,05) В результате выдерживания в среде с рН 5.0 (зоб) в течение 1 ч и при pH 3.0 (желудок) в течение 1.5 ч количество жизнеспособных клеток штамма L. acidophilus IV8 снижалось соответственно на 15,4 (2,2x109 К0Е/мл) и 26,9 (1,9x109 К0Е/мл) % по сравнению с числом микроорганизмов в начале экспериментального исследования (2,6x109 КОЕ/мл) (p<0,05). После инкубирования бактериальных клеток данного штамма при рН 7.0 (кишечник) в течение 2.5 ч наблюдали повышение их количества до 2,1x109 КОЕ/мл, что составляло 80,8% от начальной концентрации клеток лактобациллы. Различия между значениями содержания бактериальных клеток L. acidophilus IV72 были статистически не значимы (р>0,05). Полученные результаты указывают на возможность отобранных лактобацилл к сохранению на всем протяжении ЖКТ сельскохозяйственных птиц пробиотических свойств, необходимых для достижения лечебного эффекта. В рацион молодняка сельскохозяйственной птицы, прежде всего, включают высокопитательные зерновые и зернобобовые корма, содержащие некрахмалистые полисахариды - факторы, которые ухудшают процесс перевариваемости кормов, негативно воздействуют на определяющей ее здоровье и продуктивность кишечную микробиоту [3, 11]. Одним из проявлений пробиотических функций различных штаммов лактобацилл является способность их к продукции физиологически активных соединений - гидролитических ферментов, которые могут принимать участие в процессе пищеварения, улучшая перевариваемость компонентов кормов и повышая их усвояемость сельскохозяйственными животными [20]. Сравнительный анализ активности гидролаз в культуральных жидкостях L. acidophilus, полученных в процессе гомогенного глубинного их культивирования в течение 24 ч, показал существенные штаммовые различия в способности к продукции ферментов (рисунок 3)
Рис. 3. Активность гидролитических ферментов штаммов L. acidophilus: 1 - целллюлаза, 2 - ксиланаза, 3 - амилаза, 4 - протеаза, 5 - фитаза, 6 - липаза Так, среди исследуемых лактобацилл наибольшей активностью целлюлазы и амилазы (0,52±0,02 Ед./мл и 3,97±0,09 Ед./мл, соответственно) обладал штамм IV8, что в 1,4 и 1,3 раза выше по сравнению с уровнем продукции данных ферментов у штамма IV72 (р<0,05). Однако в то же время штамм IV72 характеризовался более высоким, по сравнению с штаммом IV8, уровнем биосинтеза протеазы, фитазы и липазы (соответственно 0,26±0,03 Ед./мл, 0,33±0,02 Ед./мл и 4,24±0,15 Ед./мл), активность которых была выше в 2,2, 1,7 и 1,6 раза, соответственно (р<0,05). Необходимо отметить, что в нашем исследовании в культуральных супернатантах обоих бактериальных штаммов не обнаружена ксила-назная активность. Процесс образования гидролитических ферментов микроорганизмом, в основном, зависит от условий выращивания (температура, кислотность и аэрация), состава питательной среды (содержание основных источников питания), от фазы роста и его штаммовых особенностей [1, 5]. Полученные нами результаты исследований согласуются с данными отечественных и зарубежных авторов, согласно которым штаммы L. acidophilus способны к образованию внеклеточных целллюлаз, амилаз, протеаз, фитаз и липаз [17, 20, 25]. Заключение. На основании полученных результатов отобраны два наиболее активных по антагонистическому потенциалу в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы штаммы L. acidophilus, а именно, L. acidophilus IV8 и L. acidophilus IV72. Выявленные лактобациллы проявляют высокую степень рН- и желчеустойчивости, способны к синтезу целлюлозо-, амило-, протео-, фито- и липолитических ферментов, что позволяет рекомендовать их к применению в качестве пробиотиков для птицеводства. Работа выполнена в рамках государственной программы повышения конкурентоспособности Всероссийского научно-исследовательского института фитопатологии среди ведущих мировых научно-образовательных центров и поддержана грантом Президента РФ МК-2439.2022.5 (соглашение № 075-15-2022-414 от «12» мая 2022 г). Благодарности. Авторы выражают огромную благодарность Шамилю Завдатовичу Валидову (НИЛ «Микробные биотехнологии» ИФМиБ Казанского (Приволжского) федерального университета) и Татьяне Вадимовне Багаевой (кафедра биохимии, биотехнологии и фармакологии ИФМиБ Казанского (Приволжского) федерального университета) за помощь и полезные советы в аналитических экспериментах. Список литературы: 1. Авдеева Л.В., Осадчая А.И., Хархота М.А. Биосинтез целлюлаз пробиотическими штаммами Bacillus subtilis при совместном выращивании// 2010. С. 80-89. 2. Бактерии - антагонисты возбудителей кишечных инфекций и продуценты комплекса целлюлаз как основа для создания добавок, объединяющих функции пробиотика и кормового фермента/ Л.Р. Валиуллин, Риш.С. Мухаммадиев, Рин. С. Мухаммадиев, В.И. Егоров, В.Ю. Рудь, А.П. Глинушкин// Достижения науки и техники АПК. 2021. Т. 35. № 9. С. 60-66. 3. Биопрепараты микробного происхождения в птицеводстве / Н.В. Феоктистова, А.М. Марданова, М.Т. Лутфуллин, Л.М. Богомольная, М.Р. Шарипова// Ученые записки Казанского университета. Серия Естественные науки. 2018. Т. 160. № 3. С. 395-418. 4. Влияние пробиотиков Bacillus subtilis GM2 и GM5 на рост и усвояемость кормов у цыплят-бройлеров/ Г.Ф. Хадиева, М.Т. Лутфуллин, А.А. Николаева, Н.К. Мочалова, С.Ю. Смоленцев, А.М. Марданова, М.Р. Шарипова// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2019. Т. 161, кн. 3. С. 472-489. 5. Влияние различных источников углерода и азота на продукцию ксиланаз грибом Bipolaris sorokiniana/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, Т.В. Багаева, Л.Р. Валиуллин, А.П. Глинушкин// Достижения науки и техники АПК. 2019. Т. 33. № 1. С. 41-44. 6. Выделение и изучение морфологических и биохимических свойств новых штаммов молочнокислых бактерий, перспективных для создания пробиотических препаратов/ А.С. Мухаммадиева Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин// Ветеринарный врач. 2020. № 3. С. 39-46. 7. Ивашкина Н.Ю., Ботина С.Г. Оригинальный отечественный пробиотик аципол: молекулярно-биологические и метаболические характеристики// Российский журнал гастероэнтерологии, гепатологии и колипроктологии. 2009. № 2. С.58-63. 8. Иркитова А.Н., Мацюра А.В. Эколого-биологическая характеристика Lactobacillus acidophilus// Ukrainian Journal of Ecology. 2017. № 4. С. 214-230. 9. Нейтрализация метаболитов Fusarium в растительном сырье / Л.Р. Валиуллин, Риш.С. Мухаммадиев, Рин.С. Мухаммадиев, Е.В. Скворцов, И.С. Рагинов, В.Ю. Рудь, А.П. Глинушкин// Достижения науки и техники АПК. 2020. Т. 34. № 12. С. 73-77. 10. Новые штаммы Bacillus subtilis как перспективные пробиотики/ Г.Ф. Хадиева, М.Т. Лутфуллин, Н.К. Мочалова, О.А. Ленина, М.Р. Шарипова, А.М. Мар-данова// Микробиология. 2018. Т. 87. №4. С. 356-365. 11. Оптимизация состава питательной среды пробиотического штамма B. subtilis GA24 - продуцента кормовых ферментов/ Р.С. Мухаммадиев, Л.Р. Валиуллин, Р.С. Мухаммадиев, А.С. Мухаммадиева, А.С. Сайфуллин, А.П. Глинуш-кин// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2022. Т. 250. № 2. С. 155-159. 12. Пробиотики на основе бактерий рода Bacillus в птицеводстве/ Н.В. Феоктистова, А.М. Марданова, Г.Ф. Хадиева, М.Р. Шарипова// Ученые записки Казанского университета. Серия Естественные науки. 2017. Т. 159. № 1. С. 85-107. 13. Ферментативная активность гидролаз штаммов микроорганизмов, перспективных для создания на их основе кормовых добавок и биологических консервантов/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, И.Г. Каримуллина, В.Г. Гумеров, Л.Р. Валиуллин// Состояние, проблемы и перспективы развития современной науки: материалы национальной научно-практической конференции. Брянск: Брянский государственный аграрный университет (Кокино), 2021. С. 127-133. 14. Ферментативная активность ксиланаз и целлюлаз пробиотических штаммов Bacillus subtilis/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин, В.В. Бирюля, Е.В. Скворцов// Ветеринарный врач. 2019. № 3. С. 19-23. 15. Alayande K.A., Aiyegoro O.A., Ateba C.N. Probiotics in animal husbandry: applicability and associated risk factors// Sustainability. 2020. 12(3). 10871099. 16. Antagonistic properties and biocompatibility as important principles for development of effective and biosafety probiotic drugs/ Rish.S. Mukhammadiev, A.S. Mukhammadieva, E.V. Skvortsov, E.V. Skvortsov, L.R. Valiullin, A.P. Glinushkin// IOP Conf. Ser. Earth Environ. Sci. 2021. 663. 012008. 17. Bhargavi P.L., Manjushri R., Neelakanta Reddy P. Lipase production by lactic acid bacteria in submerged and solid state fermentation// BioTechnology: An Indian Journal. 2010. 4 (3). 126-129. 18. Characterization of Lactobacillus acidophilus isolated from piglets and chicken/ Y.T. Ahn, K.L. Lim, J. Ryu, D.K. Kang, J.S. Ham, Y.H. Jang, H.U. Kim// Asian-australasian Journal of Animal Sciences. 2002. 15. 1790-1797. 19. Comparison of pH and bile resistance of Lactobacillus acidophilus strains isolated from rat, pig, chicken, and human sources/ S.C. Park, M.H. Hwang,Y.H. Kim, J.C. Kim, J.C. Song, K.W. Lee, K.S. Jeong, M.H. Rhee, K.S. Kim, T.W. Kim// World J. Microbiol. Biotechnol. 2006. 22. 35-37. 20. Dumitru M., Ciurescu G., Habeanu M. Evaluation of Lactobacillus spp. based on phenotypical profile as direct-fed microbial candidate for poultry nutrition// Archiva Zootechnica. 2021. 24. 150-166. 21. Effects of Lactobacillus acidophilus on the growth performance, immune response, and intestinal barrier function of broiler chickens challenged with Escherichia coli O157// Z. Wu, K. Yang, A. Zhang, W. Chang, A. Zheng, Z. Chen, H. Cai, G. Liu// Poult. Sci. 2021.100(9). 101323. 22. Microbiological analysis and assessment of biotechnological potential of lactic acid bacteria isolated from Tunisian flours/ I. Nachi, I. Fhoula, I. Smida, H.-I. Ouzari, M. Hassouna// Annals of Microbiology. 2019. 69. 29-40. 23. Oke M.A., Onilude A.A. Partial purification and characterization of extracellular protease from Pedicoccus acidilactici// Nigerian Journal of Basic and Applied Sciences. 2014. 22. 19-25. DOI:10.4314/njbas.v22i1.4. 24. Park Y.H., Hamidon F., Rajangan Ch. Application of probiotics for the production of safe and high-quality poultry meat// Korean J. Food Sci. Anim. Resour. 2016. 36(5). 567-576. 25. Phytase activity from Lactobacillus spp. in calcium-fortified soymilk/ A.L. Tang, G. Wilcox, K.Z. Walker, N.P. Shah, J.F. Ashton, L. Stojanovska// J. Food Sci. 2010. 75(6). M373-376. 26. Probiotics (direct-fed microbials) in poultry nutrition and their effects on nutrient utilization, growth and laying performance, and gut health: a systematic review/ R. Jha, R. Das, S. Oak, P. Mishra// Animals (Basel). 2020. 10 (10). 18631881. 27. Production of vitamins B3, B6 and B9 by Lactobacillus isolated from traditional yogurt samples from 3 cities in Iran, winter 2016/ P. Hamzehlou, A. Akhavan Sepahy, S. Mehrabian, F. Hosseini// Applied Food Biotechnology. 2018. 5(2).107-120. 28.Selectedalternativefeedadditivesusedtomanipulatetherumenmicrobiome/ M. Michalak, K. Wojnarowski, P. Cholewinska, N. Szeligowska, M. Bawej, J. Pacon// J. Animals. 2021. 11(6). 1542-1554. 29. Survival of probiotic strains of microorganisms under imitating digestion in the stomach and intestines of farm animals/ Rish.S. Mukhammadiev, Rin.S. Mukhammadiev, E.V. Skvortsov, L.R. Valiullin, A.P. Glinushkin, V.P. Kalinitchenko// IOP Conf. Ser. Earth Environ. Sci. 2021. 663. 012038. 30. Thaweesang S., Leenanon B. Survival of Lactobacillus acidophilus TISTR1338 in bile salt stress conditions// Asian Journal of Microbiology, Biotechnology and Environmental Sciences. 2016. 18(3). 569-579. Резюме. В работе проведена оценка пробиотических свойств новых штаммов L. acidophilus in vitro для определения возможности их использования в птицеводстве. Изучено 6 штаммов L. acidophilus, антагонистическую активность которых устанавливали чашечным методом. Относительно высоким антимикробным потенциалом по отношению к возбудителям кишечных инфекций молодняка сельскохозяйственной птицы характеризовались штаммы L. acidophilus IV8 и L. acidophilus IV72. Выдерживание их бактериальных клеток (2,60x109 и 5,14x109 КОЕ/мл, соответственно) в жидкой среде MRS, содержащей 1 и 5 % желчи цыплят-бройлеров, в течение 6 ч показало их устойчивость. В среде с 1% желчью выживаемость штаммов IV8 и IV72 составила соответственно 41,9 и 26,3%, в присутствии 5% желчи - 18,0 и 8,4% относительно контроля. После последовательного инкубирования в средах с рН (5.0, 3.0 и 7.0), приближенных к условиям различных отделов пищеварительного тракта птицы (соответственно зобу, желудку и кишечнику), количество жизнеспособных клеток штамма IV8 составило 2,1x109 КОЕ/мл, что сооответствует 80,8% от начальной концентрации клеток лактобациллы. Различия между значениями содержания бактериальных клеток штамма IV72 были статистически не значимы. Оба штамма лактобациллы способны секретировать в среду внеклеточные гидролитические ферменты. Наибольшей активностью целлюлазы и амилазы (0,52±0,02 Ед./мл и 3,97±0,09 Ед./мл, соответственно) обладал штамм IV8: в 1,4 и 1,3 раза выше по сравнению с уровнем продукции данных ферментов у штамма IV72. Штамм IV72 характеризовался более высоким, по сравнению с штаммом IV8, уровнем биосинтеза протеазы, фитазы и липазы (соответственно 0,26±0,03 Ед./мл, 0,33±0,02 Ед./мл и 4,24±0,15 Ед./мл), активность которых была выше в 2,2, 1,7 и 1,6 раза, соответственно. Ключевые слова: птицеводство, лактобактерии, Lactobacillus acidophilus, штамм, антагонистический потенциал, активность внеклеточных гидролитических ферментов, пробиотическая добавка, питательная среда, культивирование, антимикробный эффект. Сведения об авторах: Валиуллин Ленар Рашитович, кандидат биологических наук, старший научный сотрудник отдела экологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; 143050, Московская область, Одинцовский район, р. п. Большие Вяземы, ул. Институт, вл. 5; тел.: 8-950-9698469; е-mail: valiullin27@mail.ru. Мухаммадиев Ринат Салаватович, кандидат биологических наук, научный сотрудник отдела экологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; научный сотрудник отдела биотехнологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Тимербаева Разалия Рустамовна, кандидат ветеринарных наук, доцент кафедры эпизоотологии и паразитологии ФГБОУ ВО «Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана»; 420029, г. Казань, ул. Сибирский Тракт, 35; тел. 8-903-3401420; е-mail: 8-903-3401420@mail.ru. Каримуллина Ильсияр Габделгазизовна, кандидат биологических наук, старший научный сотрудник отдела вирусных и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-904-7699225; е-mail: 89047699225@mail.ru. Яруллин Айнур Ильнурович, кандидат биологических наук, старший научный сотрудник, заведующий отдела вирусных и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-905-3174170; е-mail: abii@mail.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, научный сотрудник отдела экологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; научный сотрудник отдела биотехнологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; е-mail: tashir9891@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|