|
||||

Распространение лейкоза крупного рогатого скота и генетические варианты возбудителя на территории животноводческих хозяйств Центрального федерального округа Российской ФедерацииУДК619:616-006:616.98:578.828. 11 Козырева Н.Г., Гулюкин М.И. ФГБНУ "Всероссийский научноисследовательский институт Введение. Среди болезней животных лейкоз представляет одну из наиболее сложных и до конца нерешенных проблем ветеринарной медицины. Несмотря на определенные усилия в борьбе против этого заболевания в России лейкоз прочно занимает первое место среди инфекционных болезней крупного рогатого скота - на него приходится около 65,8% (2015 год) учтенных случаев инфекционной патологии.
В товарном животноводстве лейкоз причиняет большой экономический ущерб [1], который выражается в преждевременной выбраковке коров, утилизации туш больных животных, нарушении воспроизводительной функции больных коров, ограничении хозяйственной деятельности в связи с неблагополучием.
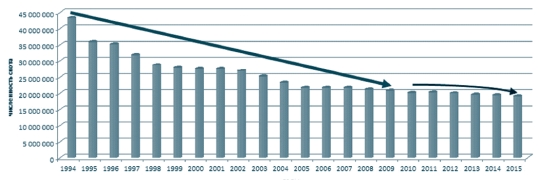
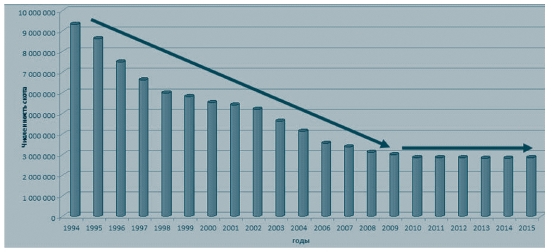
Негативная динамика развития ситуации вызывает серьезную тревогу тем, что увеличение числа больных и инфицированных вирусом лейкоза животных происходит на фоне резкого сокращения численности скота (рисунок 1, 2). С 1994 года в целом по России поголовье крупного рогатого скота по сравнению с 2015 годом уменьшилось на 56%. Снижение поголовья допущено во всех федеральных округах, в том числе в ЦФО - на 69%. Болезнь приняла в нашей стране характер эпизоотии и получила практически повсеместное распространение.
В Центральном федеральном округе содержалось в 2014 году 14,1% крупного рогатого скота, в том числе 13,5% коров от поголовья крупного рогатого скота Российской Федерации; в 2015 году - 6,2% крупного рогатого скота, в том числе 5,7% коров от поголовья крупного рогатого скота Российской Федерации [6].
Рис. 1. Поголовье крупного рогатого скота на территории Российской Федерации за период с 1994 по 2015 годы
Рис. 2. Поголовье крупного рогатого скота на территории Центрального федерального округа Российской Федерации за период с 1994 по 2015 годы Для оценки интенсивности и характеристики эпизоотического процесса, применяя эпизоотологические методы исследования, определяют ряд основных параметров, характеризующих распространение болезни и ее влияние на популяцию животных [5].
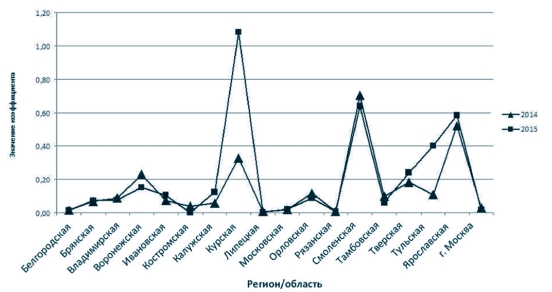
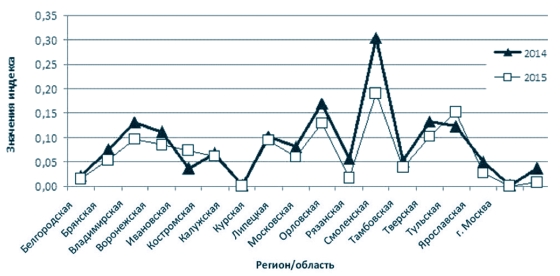
Коэффициент очаговости (Ко) показывает, сколько больных животных приходится на один неблагополучный пункт (рисунок 3). Данный показатель представляет собой отношение числа заболевших животных к числу неблагополучных пунктов и является показателем интенсивности эпизоотического процесса [5].
Рис. 3 Диаграмма интенсивности эпизоотического процесса в Центральном федеральном округе Российской Федерации за период с 2014 по 2015 годы Интенсивно эпизоотический процесс (максимальные значения Ко) за 2014-2015 годы протекал в Курской (при этом, в 2015 году Ко выше в 3,3 раза относительно 2014 года), Смоленской и Ярославской областях, при этом в 2015 году в Тульской области наблюдается увеличение Ко, что свидетельствует о напряженности эпизоотического процесса в данном субъекте ЦФО по сравнению с 2014 годом (рисунок 3).
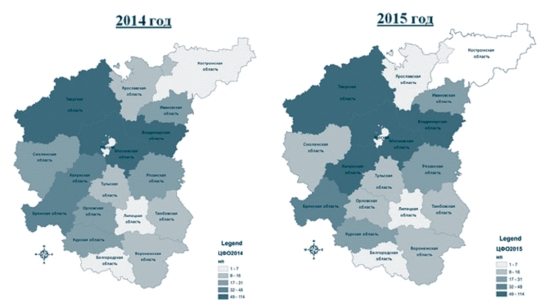
Рис. 4. Эпизоотическая ситуация по наличию неблагополучных пунктов по лейкозу крупного рогатого скота за 2014/2015 годы (в качестве платформы построения ГИС (геоинформационной системы) ФГБНУ ВИЭВ было использовано программное обеспечение AroGIS [4]) По состоянию на 1 января 2015 года было 607 неблагополучных пунктов, в 2014 году оздоровлено 99 неблагополучных пункта, но вновь выявлен 91 пункт; осталось на конец года 599 неблагополучных пунктов. Наивысший уровень неблагополучия зарегистрирован во Владимирской (80 неблагополучных пунктов), Московской (106 неблагополучных пунктов), Тверской (114 неблагополучных пунктов) областях (по данным на конец года) [6] (рисунок 4).
По состоянию на 1 января 2016 года было 599 неблагополучных пунктов, в 2015 году оздоровлено 135 неблагополучных пунктов, но вновь выявлено 82 пункта; осталось на конец года 546 неблагополучных пунктов. Пиковые значения неблагополучия зарегистрированы во Владимирской (62 неблагополучных пунктов), Калужской (78 неблагополучных пунктов), Московской (101 неблагополучный пункт), Тверской (100 неблагополучных пунктов) областях (по данным на конец года) [6] (рисунок 4).
За 9 месяцев 2016 года было выявлено 546 неблагополучных пунктов, оздоровлено 68 неблагополучных пунктов, вновь выявлено 42 пункта; осталось на конец периода 523 неблагополучных пунктов. Пики неблагополучия сохраняются за теми же регионами - во Владимирской (60 неблагополучных пунктов), Калужской (94 неблагополучных пунктов), Московской (89 неблагополучный пункт), Тверской (96 неблагополучных пунктов) областях.
Для оценки результатов широкомасштабных серологических исследований применяется модифицированный индекс превалентности - Пм, представляющий собой отношение числа положительно реагировавших животных к числу исследованных животных [5].
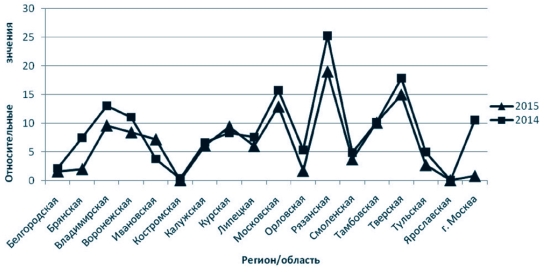
При исследовании степени пораженности за 2014-2015 годы (рисунок 5) максимальные значения Пм наблюдались в Московской, Рязанской и Тверской областях, тогда как наибольшее количество инфицированных животных выявлялось в областях: Рязанской - 50 6 74/40 7 3 8, Московской - 41 494/32 583, Воронежской - 38 978/30 888, Тверской - 17 845/22 075, Владимирской - 20 240/15 850 голов [6], соответственно. В среднем в 2014 году значения коэффициента Пм были выше на 0,02 по сравнению с 2015 годом.
Рис. 5. Диаграмма степени пораженности лейкозом крупного рогатого скота на территории Центрального федерального округа Российской Федерации за 2014-2015 годы
Рис. 6. Диаграмма инфицированности (в относительном количестве (%) серопозитивных животных) лейкозом крупного рогатого скота на территории Центрального федерального округа Российской Федерации за 2014-2015 годы
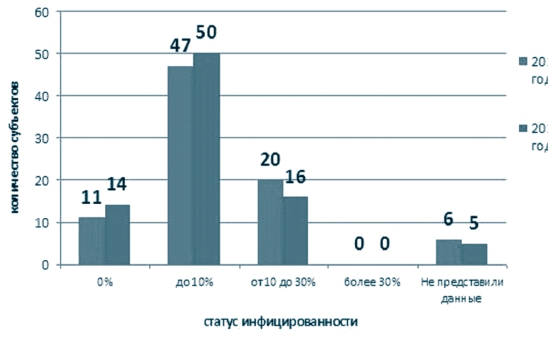
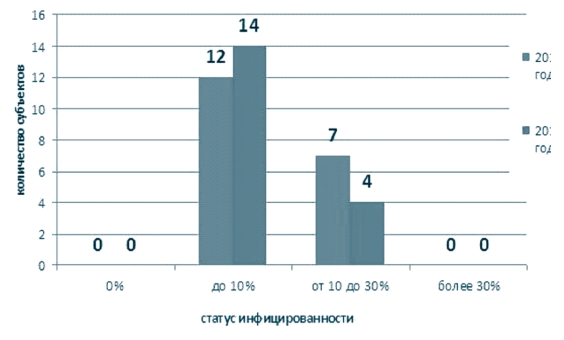
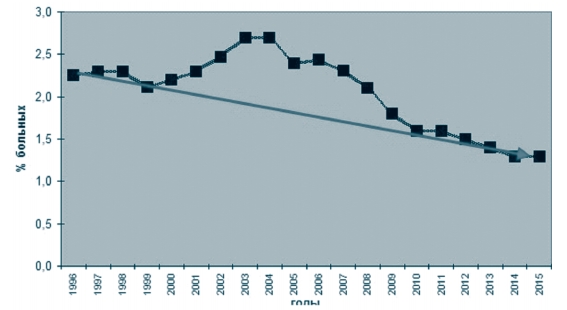
Инфицированность в среднем по округу составила в 2014 году -8,7%, с максимумом в Рязанской области (25,3%); в 2015 году - 6,5%, с максимумом в Рязанской области (19,0%) (рисунок 6), при этом численное распределение регионов (субъектов) по степени инфициро-ванности представлено на рисунках 7 - по Российской Федерации и 8 - по Центральному федеральному округу. Как видно из представленной информации основное количество субъектов находится в группе с инфицированностью до 10% (для Центрального федерального округа - это Белгородская, Брянская, Воронежская, Владимирская, Ивановская, Калужская, Костромская, Липецкая, Орловская, Курская, Смоленская, Тульская, Ярославская области и г. Москва), на втором месте - хозяйства из регионов, где инфицированность составляет от 10% до 30% (для Центрального федерального округа - это Владимирская, Воронежская, Московская, Рязанская, Тамбовская, Тверская области и г. Москва). При этом в Российской Федерации свободными от лейкоза считаются 11 (2014 год) / 14 (2015 год) субъектов, в ЦФО таких субъектов нет.
Гематологической стадии достигли в 2014 году 14 837 голов скота, сдано на убой 14 412 голов; в 2015 году - 12 004 голов крупного рогатого скота, сдано на убой 13 816 голов. На конец года в хозяйствах оставалось: 2014 год - 4 297 гематологических больных коров; 2015 год - 2 540 гематологических больных коров [6]. Превалентность (степень пораженности) (П) популяции животных лейкозом крупного рогатого скота в целом по округу в 2015 году ниже относительно 2014 года (рисунок 5).
Рис. 7. Инфицированность крупного рогатого скота по результатам РИД за 2014-2015 годы на территории Российской Федерации
Рис. 8. Инфицированность крупного рогатого скота по результатам РИД за 2014-2015 годы на территории Центрального федерального округа Российской Федерации В 2014 году в Воронежской области, где числится всего 16 неблагополучных пунктов, а инфицированность составила 11,1%, зафиксирован падёж от лейкоза 42 голов скота, тогда как в целом по России - всего 46 голов [6].
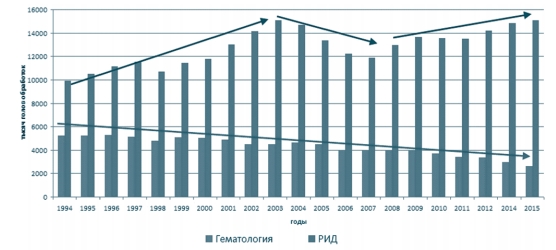
Как видно из графиков на рисунках 9 и 10 при исследовании лейкоза крупного рогатого скота в динамике за период с 1994 по 2015 годы различными методами диагностики выявлено, что в случае:
Рис. 9. Динамика проведения диагностических исследований ВЛКРС-инфекции в Российской Федерации за период с 1994 по 2015 годы
Рис. 10. Динамика выявления больного лейкозом скота в Российской Федерации за период с 1996 по 2015 годы Ввоз скота из неблагополучных регионов приводит к ухудшению эпизоотической ситуации по лейкозу. Методы контроля и карантин, применяемые при экспортно-импортных операциях, не обеспечивают предупреждение ввоза инфицированных животных при этой латентной инфекции. Для выявленных на территории Российской Федерации генетических вариантов ВЛКРС, как правило, отсутствуют данные по происхождению и перемещению инфицированного скота. Это не дает возможности проследить эволюцию вируса и влияние искусственного отбора в результате постоянной выбраковки по признаку гуморального иммунного ответа на антигены ВЛКРС, а также оценить значимость изучения таксономии вируса, основанной на секвениро-вании участков генома.
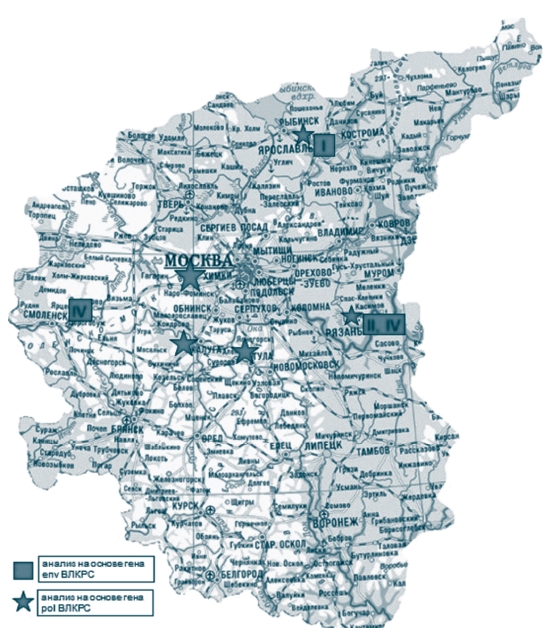
С целью изучения полиморфизма ВЛКРС и пополнения базы данных последовательностей провируса был проведен филогенетический анализ 61 изолята ВЛКРС по областям pol (12 изолятов, в том числе ранее проанализированные 9 изолятов [5]), и env (49 изолятов) [3] генома вируса. География исследования - Московская, Калужская, Рязанская, Смоленская, Ярославская, Тульская области (табл. 1, рисунок 14).
Таблица 1. География исследования и количество выявленных изолятов ВЛКРС
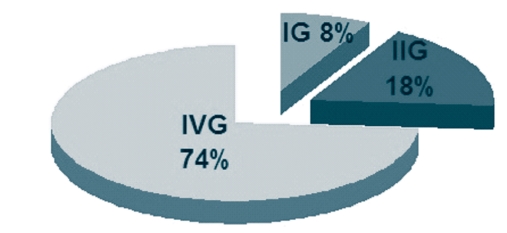
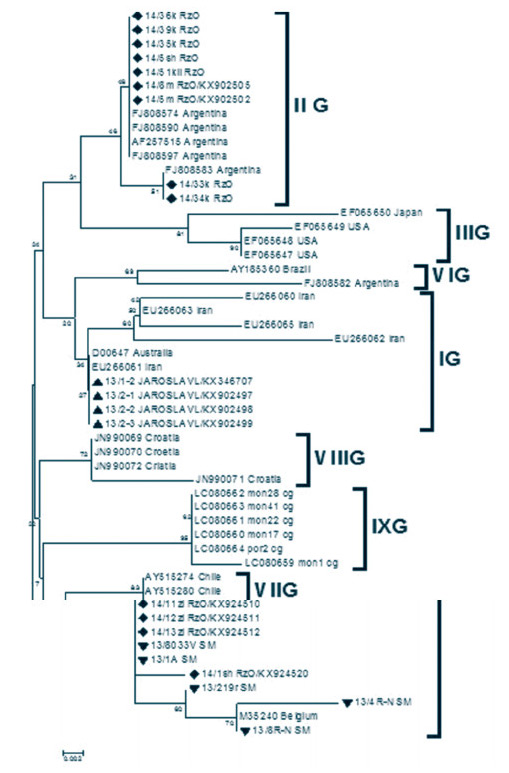
Филогенетический анализ области гена env (генотипы ВЛКРС дифференцировали согласно источникам [11, 12] с последующими дополнениями [2, 13]) показал, что популяция ВЛКРС на обследованных территориях ЦФО не однородна. Выявлены гетерогенные популяции ВЛКРС. В ходе исследования обнаружены провирусы трех генотипов. Основная доля циркулирующих провирусов приходится на IV генотип (рисунок 11). Так, на территории Рязанской области при исследовании 36 изолятов ВЛКРС обнаруживаются два генотипа вируса - II (9 изолятов) и IV (27 изолятов), и более того, в одном хозяйстве присутствуют вирусы двух генотипов. В хозяйствах Смоленской (9 изолятов) и Ярославской (4 изолята) областях выявлены по одному генетическому варианту вируса - IV и I, соответственно (рисунок 12).
На сегодняшний день в мире выявлено 9 генетических вариантов ВЛКРС [2, 11, 12, 14]. В наших исследованиях выявлено преобладание IV генотипа ("европейский кластер"), что подтверждает длительную циркуляцию на территории России варианта ВЛКРС, ввезённого из стран Европы с инфицированным крупным рогатым скотом после второй мировой войны.
Рис. 11. Структура генетического разнообразия ВЛКРС на территории Центрального федерального округа Российской Федерации (%)
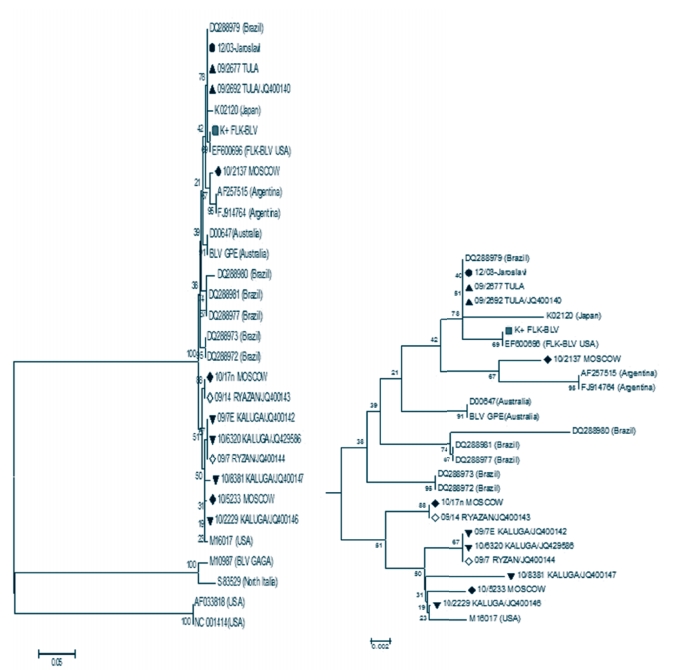
Рис. 12. Филогенетическое сравнение участков гена env изолятов ВЛКРС [Mega v.5, МЕ, Bootstrap Repl=1000, p-distance, массив 86 последовательностей] По результатам филогенетического анализа области гена pol согласно топологии филогенетического дерева на рисунке 13 выявлена принадлежность исследуемых изолятов провируса лейкоза крупного рогатого скота из регионов Центрального федерального округа Российской Федерации (5 субъектов) (табл. 2) к большой группе изолятов (внутригрупповая дивергенция не превышает 0,034), к которой отнесены штаммы из Аргентины, Австралии, Японии, США, Бразилии. С другой стороны, изоляты из России отличаются от штаммов из США (M10987 BLV GAGA), Северной Италии (S83529) и также США (NC001414, AF033818), составляющих отдельные клады (в табл. 2 выделены серой зоной). Ранее проведенные исследования [9] показали, что идентичными между собой являются рязанский 09/7RYAZAN/JQ400144 и калужские 09/7EKALUGA/JQ400142, 10/6320KALUGA/JQ429586 изоляты. На самом близком эволюционном расстоянии (0,005) с американским изолятом М16017 находится изолят 10/2229 KALUGA/JQ400146 (рисунок 13, табл. 2).
Изолят 10/2137 MOSCOW имеет высокую степень родства с аргентинским штаммом AF257515 - 99% и эволюционное расстояние в данном случае составляет 0,011. Также установлено, что изоляты 10/17n MOSCOW и 09/14RYAZAN/JQ400143 являются идентичными между собой (рисунок 13, табл. 2).
Внутри своей группы три изолята 09/2677 TULA, 09/2692TULA/JQ400140 [9] и 12/03 JAROSLAVL (выделенные от импортного скота) идентичны с бразильским изолятом DQ288979 (100%) и между собой, а также проявляют наибольшее сходство с японским К02120 (99,4%), эволюционное расстояние для которых составило 0,011, и американским EF600696 (99,7%), эволюционное расстояние в данном случае составило 0,005, изолятами, что наводит на мысль о происхождении инфицирования скота (рис.13, табл.2).
Рис. 13. Филогенетическое сравнение участков гена pol изолятов ВЛКРС [Mega v.5, NJ, Bootstrap Repl.=1000, p-distance, массив 30 последовательностей] - на филограмме представлено древо и его ветвь с анализируемыми изолятами ВЛКРС Таблица 2. Эволюционное расстояние между последовательностями изолятов ВЛКРС (участок гена pol)
Филогенетическая принадлежность российских изолятов ВЛКРС на основе участка гена pol условно коррелирует с результатами выявления филогенетического родства ВЛКРС на основе последовательностей env гена. Так, по полученным данным, изолят 12/03 JAROSLAVL находится на минимальном эволюционном расстоянии от следующих международных штаммов: японского K02120, американского EF600696, бразильского DQ288979, принадлежащих к генотипу I согласно классификации ВЛКРС по гену env [11, 12], куда также относятся исследуемые изоляты, выделенные от животных этой же группы из Ярославской области, приобретенных из неблагополучной по лейкозу страны. Для изолята 10/2137 MOSCOW [9] выявлено наибольшее сходство с аргентинским штаммом AF257515, принадлежащим к генотипу 2, а изоляты 09/2677 TULA и 09/2692 TULA/JQ400140 [9] находятся на минимальной эволюционной дистанции от бразильского DQ288979, японского K02120, американского EF600696, австралийского D00647 штаммов, которые принадлежат генотипу 1.
По результатам изучения генетического разнообразия ВЛКРС в международную базу GenBank ресурса NCBI с присвоением соответствующих регистрационных номеров депонируются последовательности генов pol (ранее 7 изолятов ВЛКРС) и env (25 изолятов: KX346707; KX902497; KX902498; KX902499; KX902500; KX902501; KX902502; KX902503; KX902504; KX902505; KX902506; KX924510; KX924511; KX924512; KX924512; KX924513; KX924514; KX924515; KX924516; KX924517; KX924518; KX924519; KX924520; KX924521; KX924522; KX924523), остальные последовательности генов pol (3 изолята) находятся в процессе регистрации.
Рис. 14. Географическое распространение генетических вариантов ВЛКРС на территории Центрального федерального округа Российской Федерации При анализе распространения инфекции в ЦФО за период 20142015 гг., используя результаты диагностического и эпизоотического мониторингов, статистические данные, информацию по отдельным регионам можно сделать следующие выводы:
Заключение. Объективность оценки уровней распространенности лейкоза достигается при учете всех источников возбудителя, как гематологических больных, так и инфицированных животных. При неполном охвате серологическим тестированием и недостаточном производстве диагностикумов отчетные данные, таким образом, не отражают достоверную эпизоотическую ситуацию по данному заболеванию, что также тормозит оздоровительную работу в хозяйствах, препятствует изучению эпизоотического мониторинга во многих субъектах.
Широкому и неравномерному распространению болезни способствуют отсутствие организационных звеньев по принятию управленческих решений по проблеме лейкоза крупного рогатого скота, продолжительность неблагополучия стад по лейкозу, отсутствие на местах систематической работы по организации и проведение проти-волейкозной работы, передержка в стадах больных и инфицированных животных, отсутствие изолированного выращивания молодняка, недостаточное карантинирование завозимого скота. На местах недостаточно уделяется внимание профилактике инфекции, что способствует выявлению новых неблагополучных пунктов.
В сложившихся условиях назрела необходимость принятия новой методологии борьбы с болезнью, использующей преимущественно результаты серологических исследований и на их основании проведение всей противолейкозной работы, основными методами которой является выявление больных и инфицированных животных с последующим удалением их из стада.
Однако, одним из наиболее актуальных и наименее разработанных аспектов диагностики индуцированной ВЛКРС инфекции является выявление ВЛКРС инфицированных перинатально телят. Сложность серологической диагностики инфекции в период от рождения до 6 месяцев заключается, во-первых, в наличии колостральных антител против ВЛКРС, которые телёнок получает от матери в первые часы жизни, во-вторых, в слабо выраженном гуморальном иммунном ответе на инфицирование в перинатальный период или его полном отсутствии. Поэтому, применение высокочувствительного молекулярно-биологического метода (ПЦР), не зависящего от присутствия антител, позволит решить проблему диагностики ВЛКРС-инфекции у телят в раннем возрасте.
Источниками информации для проведения эпизоотологических исследований являются исходные материалы, позволяющие получить ориентировочную оценку ситуации по лейкозу. В данном случае переработанная информация основывается на статистических данных. Для вычисления всех показателей/характеристик эпизоотического процесса использовали данные ежегодных мониторинговых исследований лаборатории лейкозологии ВИЭВ им. Я.Р. Коваленко, статистическую отчетность ФГБУ "Центр ветеринарии" МСХ РФ за 2014, 2015 гг., 9 месяцев 2016 года, ресурс сайта РОССТАТа (http://www.gks.ru/ wps/wcm/connect/rosstat_main/ rosstat/ru/statistics/databases/).
Данная работа выполнена в рамках государственного задания (направление исследований №0578-2014-0004, №0578-20140025).
Список литературы:
Резюме. В статье представлены данные по распространению и изменению эпизоотической ситуации по лейкозу крупного рогатого скота на территории Центрального Федерального округа Российской Федерации в период 2014-2015 годов и 9 месяцев 2016 года. Дана оценка интенсивности эпизоотического процесса с помощью основных параметров, характеризующих распространение болезни, таких как: гаэффициент oчaгoвocти (Ko), модифицированный индекс превалентности (Пм). Представлена динамика серологических и гематологических исследований за период 1994-2015 гг. По результатам проведенного филогенетического анализа области гена env дана оценка гетерогенности исследуемой популяции возбудителя, выявлены 3 генотипа вируса - I,II,IV с преобладающим IV генотипом. Этот факт подтверждает длительную циркуляцию на территории РФ генетического варианта ВЛКРС, ввезённого из стран Европы с инфицированным крупным рогатым скотом после II-ой мировой войны. По результатам филогенетического анализа области гена pol обнаружена принадлежность исследуемых изолятов провируса лейкоза крупного рогатого скота из 5 субъектов Ценрального федерального округ Российской Федерации к большой группе изолятов, к которой отнесены штаммы из Аргентины, Австралии, Японии, США, Бразилии, С другой стороны, изоляты из России отличаются от международных штаммов из США (M10987), Северной Италии (S83529) и также США (NC001414, AF033818). Проведен анализ эволюционных дистанций внутри групп изолятов: дивергенция внутри группы с исследуемыми изолятами не превышала 0,034. По данным исследования филогенетическая принадлежность российских изолятов ВЛКРС на основе участка гена pol условно коррелирует с результатами выявления филогенетического родства ВЛКРС на основе последовательностей env гена.
Ключевые слова: лейкоз крупного рогатого скота, эпизоотический процесс, противоэпизоотические мероприятия, неблагополучие, инфицирован-ность, серологическая диагностика, диагностический мониторинг, вирус лейкоза крупного рогатого скота (ВЛКРС), филогенетический анализ, генетические варианты вируса.
Сведения об авторах:
Гулюкин Михаил Иванович, доктор ветеринарных наук, профессор, Академик Российской академии наук (РАН), Заслуженный деятель науки Российской Федерации, заведующий лабораторией лейкозологии ФГБНУ "Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко" (ФГБНУ ВИЭВ); 109428, г. Москва, Рязанский проспект, д. 24, к. 1; тел.: 8-495-9700367; е-mail: admin@viev.ru.
Ответственный за переписку с редакцией: Козырева Наталия Геннадиевна, кандидат биологических наук, ведущий научный сотрудник лаборатории лейкозологии ФГБНУ "Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко" (ФГБНУ ВИЭВ); 109428, г. Москва, Рязанский проспект, д. 24, к. 1; тел.: 8495-9700366; e-mail: nk07-73@mail.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|