УДК: 57.083.33:616.98:578.826:636.592
DOI 10.33861/2071-8020-2025-5-33-35
Оригинальное эмпирическое исследование
Красков Д. А., Джавадов Э. Д., Веретенников В. В., Тарлавин Н. В. Федеральное государственное бюджетное образовательное
учреждение высшего образования «Санкт-Петербургский государственный университет ветеринарной медицины»,
г. Санкт-Петербург
Аннотация. На данный момент в Российской Федерации одной из высокорентабельных отраслей птицеводческой промышленности является индейководство. В индейкодстве кроме общих болезней для птиц (болезнь Ньюкасла, грипп птиц, инфекционный энцефаломиелит) есть и специфические болезни, одна из которых геморрагический энтерит индеек. Данная иммунодепрессивная болезнь всё чаще встречается на индейководческих птицефабриках России, что приводит к экономическим потерям. К сожалению, на рынке Российской Федерации существует всего лишь один зарегистрированный серологический набор иммуноферментного анализа для выявления антител в сыворотке крови индеек. Задачей настоящего исследования являлась разработка компонентов для проведения серологических реакций, как для выявления антител, так и для выявления антигена вируса геморрагического энтерита индеек в паталогическом материале. В статье описаны способы получения положительных и отрицательных антигенов и антител к вирусу геморрагического энтерита индеек. Благодаря этому научные исследования смогут продвинуться в разработке таких серологических тестов как реакция диффузионной преципитации, реакция латекс-агглютинации, реакция иммуноэлектроосмофореза и метод имму-ноферментного анализа. При проверке данных компонентов в реакции диффузионной преципитации и реакция латекс-агглютинации были получены положительные результаты. Это свидетельствует о том, что в дальнейшем полученные антигены и антитела к вирусу геморрагического энтерита индеек, можно будет использовать для создания различных серологических наборов.
Ключевые слова: геморрагический энтерит индеек, серологические реакции, антиген, антитела, реакция диффузионной преципитации, реакция латекс агглютинации.
Учитывая постоянный рост спроса на мясо птицы у граждан Российской Федерации, птицеводческая промышленность России имеет важную задачу по обеспечению достаточным количеством продовольствия. Для того, чтобы данная задача выполнялось необходимо модернизировать существующие и открывать новые птицефабрики. В данной статье затронута индейководческая отрасль птицеводческой промышленности, так как на данный момент она является актуальной и имеет стремительные темпы роста.
К сожалению, иммуносупрессия оказывает значительное негативное влияние на сохранность птицепоголовья и, следовательно, представляет собой ключевую экономическую проблему и угрозу отечественной индейководческой промышленности. В то время как факторы стресса и плохое питание способствуют иммуносупрессии, многие инфекционные болезни индюшат вызваны вирусами иммунодепрессивных болезней, одним из которых является вирус геморрагического энтерита индеек.
Геморрагический энтерит индеек (далее, ГЭИ) – это высококонтагиозная и иммунодепрессивная инфекционная болезнь, вызванная ДНК содержащим вирусом из второй группы птичьих аденовирусов, семейства Adenoviridae, рода Siadenovirus, поражающая в основном индеек и фазанов [1, 3, 4, 9, 10]. Данная болезнь характеризуется депрессией, диареей с примесью крови в помёте, обезвоживанием, снижением температуры тела и различными осложнениями от секундарной микрофлоры [5, 8]. Основными способами подтверждения данной болезни являются следующие серологические методы диагностики: реакция нейтрализации (далее, РН), реакция диффузионной преципитации (далее, РДП) и метод иммуноферментного анализа (далее, ИФА), а также молекулярно-биологические методы [7].
Улучшение методов борьбы с иммунодепрессивными болезнями – приоритет для птицеводческой промышленности. Одним из наиболее важных методов является разработка серологических способов диагностики данной болезни, для своевременного обнаружения возбудителя болезни в хозяйстве и антител к нему, а также для контроля иммунного статуса птицы после вакцинации.
Однако, чтобы серологическая диагностика ГЭИ была наиболее точной, необходимо следовать всем правилам по наработке компонентов, которые входят в состав серологических наборов для диагностики ГЭИ. В нашем случае наша команда занимается разработкой таких серологических способов диагностики, как реакция диффузионной преципитации и реакция латекс агглютинации.
Именно поэтому целью работы в данной статье является описание подбора компонентов (положительных и отрицательных антигенов и сыворотки) для создания качественных серологических способов для диагностики геморрагического энтерита индеек.
Материалы и методы исследований. Исследования и подбор компонентов для создания серологического способа диагностики были выполнены на базе Научно-консультационного диагностического центра по птицеводству кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО СПБГУВМ.
Для разработки компонентов использовался штамм вируса геморрагического энтерита индеек «DK-24», живая вакцина против ГЭИ, агар Дифко, карбоксилированный латекс, буферные растворы и индейка тяжелого кросса Биг-6.
Вся птица на время получения компонентов находилась в клетках «Практик-сетка» 2-12 «МultiPro» по 5 голов в каждой клетке на начало опыта по наработке компонентов, и по 1 голове на конец опыта. Благодаря данной отработанной методике посадки, птица получала достаточное количество корма и воды, из-за чего в дальнейшем было получено большее количество сыворотки крови.
Результаты исследований и их обсуждение. Положительные и отрицательные антигены и сыворотка для серологических реакций были получены следующим способом:
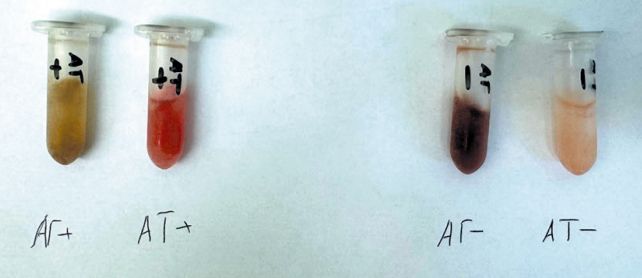
1 – положительный инактивированный антиген, супернатант гомогената селезенки индейки 35-ти дневного возраста зараженной перорально в дозе 0,5 мл на голову с титром в РДП 1:2, штаммом вируса геморрагического энтерита индеек «DK-24», семейства Adenoviridae, рода Siadenovirus №110 (коллекции штаммов – возбудителей особо опасных болезней, используемых в ветеринарии и животноводстве ФГБНУ «ФЦТРБ – ВНИВИ») для производства диагностикумов, инактивированных и рекомбинантных вакцин. Гомогенат селезенок получали путем перетирания органов в ступке с пестиком с добавлением антибиотиков и физиологического раствора в количестве равным весу селезёнки. Супернатант получали путем центрифугирования гомогената селезенок индеек при 3000 об/мин в течение 30 минут. Супернатант инактивировали добавлением теотропина 0,3% от объёма антигена, далее ставили флакон с супернатантом на сутки в термостат при температуре 37°С. После инактивации для консервации инактивированного антигена добавляли мертиолят, до конечной концентрации 1:10000, 1 час выдерживали при комнатной температуре и убирали в холодильник. По внешнему виду антиген представляет собой жидкость светло-коричневого цвета (рисунок 1).
2 – положительная сыворотка крови с антителами к вирусу ГЭИ, – полученная путем иммунизации индеек живой вакциной «Dindoral» |(Merial, Франция) – вакцинация проводилась в 28-дневном возрасте. Через 4 недели проводили ревакцинации инактивированным антигеном смешанным с гидрооксидом аллюминия, после чего отбор сыворотки крови проводился через 5 недель после ревакцинации. У индеек в возрасте 100 дней отбирали по 5 мл сыворотки крови в пробирки с активатором свертывания крови и разделительным гелем. Пробирки подвергали центрифугированию при 3000 об/мин в течение 10 минут, полученную сыворотку крови отбирали одноканальной автоматической пипеткой в эппендорфы. Титр антител контролировался с помощью ИФА набора: «ИФА Бест-Вет AT-HEV»). Для консервации сыворотки крови добавляли мерти-олят до конечной концентрации 1:10000, 1 час выдерживали при комнатной температуре и убирали в холодильник. По внешнему виду сыворотка представляет собой жидкость светло-красного цвета (рисунок 1).
3 – отрицательный антиген, супернатант гомогената селезенки индейки 35 дневного возраста. Для консервации инактивированного антигена добавляли мертиолят до конечной концентрации 1:10000, 1 час выдерживали при комнатной температуре и убирали в холодильник. По внешнему виду отрицательный антиген представляет собой жидкость тёмно-красного цвета (рисунок 1).
Супернатант проверялся с помощью классического ПЦР на наличие контаминации вирусом ГЭИ [6].
4 – отрицательная сыворотка крови не вакцинированной индейки. Сыворотку крови получали по той же методике, что описана во втором пункте. Для консервации сыворотки крови добавляли мер-тиолят до конечной концентрации 1:10000, 1 час выдерживали при комнатной температуре и убирали в холодильник. Отсутствия титра антител контролировался с помощью ИФА набора: «ИФА Бест-Вет AT-HEV»). По внешнему виду отрицательная сыворотка представляет собой полупрозрачную жидкость светло-розового цвета (рисунок 1).
После получения компонентов для проведения серологический реакций, их использовали для постановки РДП [2], а также для разработки и проведения РЛА. Исследование проб сывороток крови и антигена проводили в соответствии с методическими рекомендациями по постановке РДП и реакции латекс-агглютинации (далее, РЛА).

Рис. 1. Компоненты для серологических реакций
При проверке и отработке рабочих разведений компонентов для серологических реакций в РДП и РЛА были получены положительные результаты. Заранее известные положительные сыворотки и антиген в РДП сработали с образованием полосы преципитации, а отрицательные сыворотки и антиген не образовывали при реакции полос преципитации. В РЛА латекс с адсорбированным антителами взаимодействовал с положительным антигеном вируса геморрагического энтерита индеек вследствие чего происходила агглютинация, с нормальным антигеном и физиологическим раствором агглютинации не происходило.
Заключение. Таким образом, разработанный набор компонентов для серологических реакций, может быть использован для выявления антител в сыворотке крови и выявление антигена в супернатанте органов-мишеней вируса геморрагического энтерита индеек в РДП, а также для выявления вируса ГЭИ в супернатанте органов-мишеней в РЛА. Данные компоненты можно использовать не только в РДП и РЛА, а также для разработки РИЭОФ, ИФА, реакции непрямой гемагглютинации (РНГА).
Исследование выполнено за счет гранта Российского научного фонда № 24-26-20116 «Разработка отечественных серологических тест-систем для диагностики иммунодепрессивных болезней птиц» и Санкт-Петербургского научного фонда.
Список литературы:
1. Джавадов Э. Д., Красков Д. А. Геморрагический энтерит индеек. БИО. 2021; (7 (250): 16-19.
2. Красков Д.А., Джавадов Э. Д., Тарлавин Н. В. [и др.]. Диагностика геморрагического энтерита индеек с использованием реакции диффузионной преципитации. Ветеринария Кубани. 2025; (3): 26-28.
3. Красков Д. А., Джавадов Э. Д., Веретенников В. В. [и др.]. Изучение биологических свойств возбудителя геморрагического энтерита индеек. Международный вестник ветеринарии. 2024; (4): 52-58.
4. Красков Д. А. Геморрагический энтерит индеек. Современные представления о болезни. Ветеринария в АПК. 2024: 83-85.
5. Новикова О. Б., Герасимова А. О., Красков Д. А. Сравнительный анализ микрофлоры, выделяемой от сельскохозяйственной птицы разных видов, и контроль бактериальных болезней в птицехозяйствах. Вестник Курганской ГСХА. 2024; (4 (52): 31-40.
6. Красков Д. А., Джавадов Э. Д., Веретенников В. В., Тарлавин Н. В. Разработка молекулярно-биологического способа диагностики геморрагического энтерита индеек. Нормативно-правовое регулирование в ветеринарии. 2024; (4): 37-39.
7. Dhama K. et al. Haemorrhagic enteritis of turkeys – current knowledge. Veterinary Quarterly. 2017; (37 (1): 31-42.
8. Koncicki A. et al. Effect of infection of turkeys with haemorrhagic enteritis adenovirus isolate on the selected parameters of cellular immunity and the course of colibacillosis. Pol J Vet Sci. 2012; (15 (2): 215-220.
9. Palya V. et al. Investigation of field outbreaks of turkey haemorrhagic enteritis in Hungary. Acta Vet Hung. 2007; (55 (1): 135-149.
10. Quaye A. et al. Characterizing the splice map of Turkey Hemorrhagic Enteritis Virus. Virol J. 2024; (21 (1): 175.
Сведения об авторах:
Джавадов Эдуард Джавадович, академик РАН, доктор ветеринарных наук, профессор кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-9666774; e-mail: vnivip1@mail.ru.
Веретенников Владислав Валерьевич, кандидат ветеринарных наук, старший преподаватель кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8778769; e-mail: vlad.veretennikov.96@mail.ru.
Тарлавин Николай Владимирович, кандидат ветеринарных наук, старший преподаватель кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8430353; e-mail: tarlav1995@bk.ru.
Ответственный за переписку с редакцией: Красков Дмитрий Андреевич, ассистент кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-4152266; e-mail: kraskov-00@bk.ru.
Заявленный вклад авторов:
Красков Д.А.: разработка концепции, проведение исследования, разработка методологии, визуализация.
Джавадов Э.Д.: научное руководство.
Веретенников В. В.: проведение исследования, получение финансирования.
Тарлавин Н. В.: предоставление ресурсов, валидация результатов.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
http://www.vetkuban.com/num5_202509.html