|
||||

Очистка амилазы и протеазы мутантного штамма bacillus subtilis и их характеристикаУДК 577.112;579.64 Оригинальное эмпирическое исследование Валиуллин Л. Р., Мухаммадиев Риш. С., Мухаммадиев Рин. С. Федеральное государственное бюджетное научное учреждение «Всероссийский Аннотация. Среди разнообразия биологически активных соединений бацилл особый интерес представляют внеклеточные гидролитические ферменты. В этом плане основной предмет исследований последних лет обращен на амилазы и протеазы, составляющих два из трех крупнейших групп промышленных ферментов. В настоящей работе из культуральной жидкости мутанта Bacillus subtilis (штамм 9) фракционированием сульфатом аммония, ионобменной и гель-фильтрационной хроматографий выделены и очищены протеаза и амилаза со степенью очистки 10,06 и 13,65, выходом 28,2 и 32,4%, удельной активностью 17,9 и 113,3 ед./мг белка, соответственно. Установлены физико-химические свойства очищенных ферментов мутантного штамма бациллы. Молекулярный вес нативных молекул протеазы и амилазы, определенный методом гель-хроматографии, оказался равным, соответственно, 44,0±2,0 и 156,0±2,5 кДа. Согласно результатам электрофореза и гель-хроматографии, протеаза бактериального штамма представляла собой мономер, состоящий из одной субъединицы, амилаза – гомодимер с двумя одинаковыми субъединицами. Обе гидролазы бациллы характеризовались pH- и температурным устойчивостью. Протеаза штамма сохраняла наибольший уровень гидролазной активности при выдерживании его в течение 60 мин при значениях рН от 7,0 до 9,0 ед., амилаза – от 5,9 до 6,1 ед. Активность обоих гидролаз находилась почти на максимальном уровне при инкубации ферментов в течение 60 мин в пределах температур от 47,0 до 57,0°С. Полученные результаты открывают перспективы дальнейшего промышленного использования очищенных гидролитических ферментов бациллы при разработке кормовых добавок для сельскохозяйственных животных. Ключевые слова: Bacillus subtilis, мутантный штамм, амилаза, протеаза, выделение, очистка, характеристика, молекулярный вес, физико-химические свойства, кормовая добавка, животноводство. В настоящее время существует значительное количество научных исследований, которые посвящены биотехнологическому потенциалу микроорганизмов, способных образовывать разнообразные по структуре и свойствам активные соединения [1, 2]. Особый интерес среди последних представляют внеклеточные гидролитические ферменты [3, 4]. По приблизительным оценкам из микроорганизмов получено в чистом виде и охарактеризовано более ста указанных ферментов, классификация которых обусловлена типом расщепляющего ими субстрата [5, 6]. Благодаря уникальной способности этой группы белков к расщеплению широкого спектра полимерных молекул, они находят применение в различных отраслях промышленности – от пищевой и фармацевтической до биотехнологической и экологической [5, 7]. Основной предмет исследований последних лет обращен на амилолитические и протеолитические ферменты, продуцируемые бактериями и грибами [3, 8]. Амилазы и протеазы входят в группу промышленных ферментов и на них приходится колоссальная доля продаваемых в мире ферментных препаратов [7]. В промышленном животноводстве амилазы и протеазы отдельно или совместно с пробиотиками могут применяться в качестве добавок для увеличения доступности присутствующих в кормах трудноусвояемых компонентов, оптимизации функционирования и коррекции расстройства пищеварительной системы сельскохозяйственных животных [9, 10]. Несмотря на многочисленность исследований в этом направлении, главной проблемой использования данных классов ферментов и их продуцентов в животноводстве заключается в поиске наиболее эффективных штаммов и получении суперпродуцентов с улучшенными свойствами [11, 12]. При этом остаются мало исследованными вопросы, связанные со свойствами и функциями многих амилолитических и протеолитических ферментов. Следует отметить, что для эффективного промышленного использования любых биологически активных веществ, в том числе амилаз и протеаз, требуется их характеристика по биологическим и физико-химическим свойствам, что, в свою очередь, предполагает получение их в гомогенном состоянии [13, 14]. В связи с этим становится актуальной задачей изучение свойств амилолитических и протеолитических ферментов культуральной жидкости полученного нами пробиотического штамма бациллы – продуцента кормовых ферментов [15, 16]. В настоящее время в силу разных причин не существует универсальных подходов выделения и получения высокоочищенных экзогидро-лаз из бактерий рода Bacillus [17, 18]. Обычно разработанные способы очистки указанных ферментов из культуральной среды бацилл основаны на использовании индивидуально подобранных сорбентов и различных видов хроматографий. Цель настоящей работы - выделение, очистка и характеристика амилазы и протеазы, секретируемых клетками мутантного штамма B. subtilis 9. Материалы и методы исследований. Объект и условия культивирования. В работе использован мутантный штамм Bacillus subtilis 9 – продуцент кормовых ферментов. Штамм бациллы глубинно выращивали на ранее указанной среде [15] с соответствующими индукторами биосинтеза гидролаз на инкубаторах-качалках: скорость перемешивания – 180 об/мин, температура – (37±1)°С, длительность культивирования – 48 ч. Выделение и очистка ферментов. Супернатант отделяли от бактериальных клеток, находящихся в экспоненциальной фазе роста, центрифугированием культуральной жидкости бациллы (8 тыс. g, 18 мин, (4±1)°C). Ферменты из супернатанта штамма бациллы выделяли высаливанием белков сульфатом аммония, получая фракции от 30,0 до 80,0 % от их насыщения (24 ч, (4±1)°С) [16]. Осадок отделяли от супернатанта центрифугированием (10 тыс. g, 15 мин, (4±1)°С), растворяли в 50,0 мМ Tris-HCl буфере (pH 7,2-7,5) (далее – рабочий буфер) и диализовали осажденные белки в специальных мешках (от 12,0 до 14,0 кДа, производство «Orange Scientific», Бельгия) против рабочего буферного раствора (несколько смен в течение суток). Фильтрат белкового образца получали как описано в эксперименте [13]. Первоначально хроматографическую очистку ферментов бациллы проводили, применяя колонку с носителем DEAE-Sepharose, который уравновешен рабочим буферным раствором, затем – колонку с носителем Sephadex G-100. В случае анионобменной хроматографии элюцию связавшихся с носителем ферментов осуществляли путем увеличения концентрации NaCl до 1,0 М, в случае гель-фильтрации – рабочим буфером. Концентрация белка, степень чистоты, молекулярная масса и активность ферментов. Концентрацию белка в получаемых препаратах выявляли спектрофотометрически [13]. Степень чистоты ферментных препаратов бациллы оценивали электрофорезом [19] в 12,5% ПААГ, используя маркерные белки PageRulerTM Prestained Protein Ladder (фирма «Fermentas», Латвия). Молекулярную массу нативных ферментов определяли хроматографически с помощью колонки (1,5?50 см, фирма «Bio-Rad», США) с носителем Sephadex G-100 (от 40,0 до 120,0 мкм, производство «Pharmacia», Швеция). Элюцию белков с гель-фильтрационного носителя осуществляли рабочим буфером. Расчет молекулярного веса ферментов проводили построением калибровочной зависимости, используя значения объемов элюции низкомолекулярных белков-стандартов (?-химотрипсин, БСА, пероксидаза, лизоцим). Активность ферментов измеряли с описанными ранее методами [11]. В качестве субстратов для определения протеолитической и амилолитической активности использовали соответственно растворимый крахмал и казеин («Sigma», США). За единицу активности ферментов принимали свойство белка гидролизовать грамм субстрата в общепринятых условиях. Физико-химические свойства ферментов. Для изучения рН-стабильности ферменты инкубировали в течение 60 мин в 50 мМ буферных растворах (цитратный буфер с рН от 3,0 до 6,0 ед., фосфатный буфер с pH от 6,0 до 8,0 ед. и трис-HCl буфер с pH от 8,0 до 9,0 ед.) при оптимальной для функционирования белков температуре [15]. Остаточную активность гидролаз оценивали через определенные промежутки времени и рассчитывали в процентах от контрольных значений активности. Температурную стабильность ферментов исследовали их инкубированием в течение 60 мин в диапазоне температур от (20,0±1) до (80,0±1)°C при оптимальной для функционирования белков рН условиях [15]. Остаточную гидролазную активность ферментов выражали в процентах. Статистический анализ. Эксперименты осуществляли не менее чем в 3 повторностях и анализ значений данных проводили, применяя программное обеспечение Microsoft Office Excel 2016 («Windows», США). Статистическую обработку и достоверность результатов выявляли методами вариационной статистики, однофакторного дисперсионного анализа и апостериорного теста (p?0,05). Результаты исследований и их обсуждение. В предыдущих работах была проведена очистка и характеристика ксиланазы и целлюлазы мутантного штамма B. subtilis 9 [15, 16]. В настоящей работе выделены, очищены и изучены физико-химические свойства амилазы и протеазы, секретируемых клетками данной бациллы. Поскольку продуцент был способен продуцировать в культуральную среду различные карбогидразы, необходимо было подобрать условия разделения необходимых продуктов от балластных веществ. Выделение гидролаз из культуральной жидкости мутанта B. subtilis 9 проводили дробным высаливанием культуральной среды сульфатом аммония от 20,0 до 80,0% насыщения. Установлено, что ферменты бактериального штамма осаждались сульфатом аммония в пределах от 20,0 до 70,0%, однако наибольшая степень осаждения, удельная активность амилазы и протеазы выявлена при концентрации сернокислого аммония соответственно 65,0 и 70,0% (результаты не представлены). В указанных условиях активность протеазы и амилазы бациллы увеличивалось (p?0,05) в 1,84 и 2,20 раза по сравнению с ферментативной активностью культуральной жидкости, выход белков составил 69,8 и 83,8%, соответственно. Понижение (менее 35,0%) или повышение (более 70,0%) насыщения сульфата аммония в культуральном супернатанте приводило к уменьшению выхода белков, что, по-видимому, связано с денатурацией гидролаз. Осажденные сернокислым аммонием белковые образцы бактериального штамма были подвергнуты ионообменной хроматографии на колонке с сорбентом ДЭАЭ-сефароза, уравновешенной рабочим буфером (рисунок 1, а).
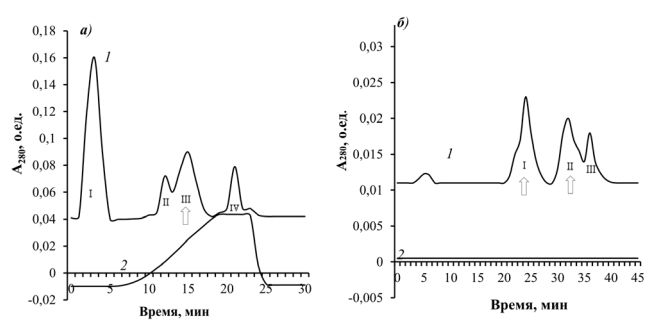
Рис. 1. Хроматограмма очистки амилазы и протеазы мутантного штамма B. subtilis 9 ионообменной (а) и гель-фильтрационной хроматографией (б): 1 – белок; 2 – линейный градиент NаСl. Стрелками указаны белковые пики ферментов. Проведение хроматографического разделения при указанных значениях рН позволило отделить большую часть балластных веществ и карбогидраз (пики I, II, IV) от амилолитических и протеолитических ферментов бациллы. Ферменты, обладающие гидролазной активностью (пик III), прочно связывались с сорбентом и при элюировании с носителя выходили в зоне высокого содержания натрия хлорида (пик указан стрелкой). Поскольку полученные препараты ферментов обладали недостаточной степенью чистоты и требовали дальнейшего разделения фракции пика III были объединены и после диализа против рабочего буферного раствора очищены гель-фильтрационной хроматографией на колонке с сорбентом Сефадексом G-100 (рисунок 1, б). Анализ ферментативной активности показал, что протеаза и амилаза выходят в виде 2-ух основных пиков (пики II и III), которые были очищены в 10,06 и 13,65 раза с удельной активностью 17,9 и 113,3 ед./мг белка соответственно (табл. 1 и 2). Полученные пики использовали для дальнейшей работы. Таблица 1 Очистка амилазы культуральной жидкости мутанта B. subtilis 9
ФА – ферментативная активность 1 Суммарная ферментативная активность = ФА × объем (мл). Таблица 2 Очистка протеазы культуральной жидкости мутанта B. subtilis 9
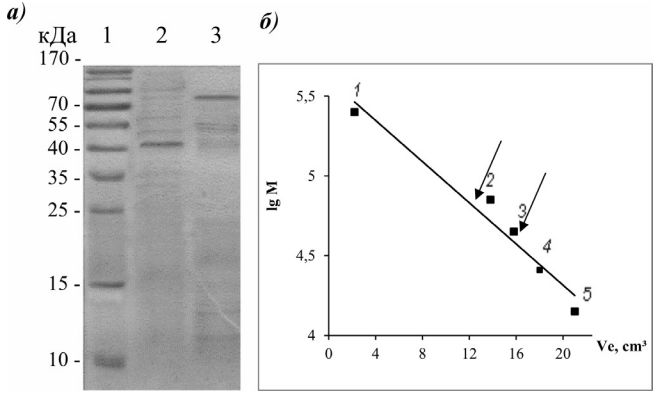
ФА – ферментативная активность 1 Суммарная ферментативная активность = ФА × объем (мл). При электрофоретическом исследовании препараты протеазы и амилазы мигрировали как один полипептид с молекулярным весом (44,0 ± 1,5) и (78,0 ± 2,0) кДа соответственно (рисунок 2, а). Гель-фильтрационный анализ нативных белков показал сходство и различие по молекулярному весу: масса протеазы находилась в пределах (44,0 ± 2,0) кДа, амилазы – (156,0 ± 2,5) кДа (рисунок 2, б).
Рис. 2. Электрофоретическая (а) и гель-фильтрационная (б) характери- 27 стика гидролаз мутантного штамма B. subtilis 9: а) 1 – маркеры молекулярной массы, 2 – амилаза после хроматографий, 3 – протеаза после хроматографий; б) 1 – бычий сывороточный альбумин (70,0 кДа), 2 – овальбумин (45,0 кДа), 3 – ?-химотрипсин (26,0 кДа), 4 - лизоцим (14,0 кДа). Стрелками указаны объемы элюции ферментов. Результаты анализа полученных молекулярных масс разными методами и последующего их сопоставления позволило заключить, что внеклеточная протеаза состоит из одной субъединицы с весом ~44,0 кДа, амилаза – двух субъединиц, каждая из которых имеет вес ~78,0 кДа. Эти две экзоферменты представлены по своей структурной организации: амилаза – мономерный, а протеаза – димерный белок. Одной их важных характеристик гидролитических ферментов, применяемых в качестве добавки к корму сельскохозяйственных животных, является pH – и температурная стабильность [20]. Использование стабильных ферментов в животноводстве позволяет повышать питательную ценность кормов и снизить себестоимость последних. Установлено, что обе гидролазы мутанта B. subtilis 9 проявляли pH- и температурную стабильность (табл. 3). Таблица 3 Основные физико-химические свойства амилазы и протеазы мутанта B. subtilis 9
Протеаза бактериального штамма сохраняла наибольший уровень гидролазной активности при выдерживании его в течение 60 мин при значениях рН от 7,0 до 9,0 ед., амилаза – от 5,9 до 6,1 ед. Активность обоих гидролаз находилась почти на максимальном уровне при инкубации ферментов в течение 60 мин в пределах температур от 47,0 до 57,0°С. Физико-химические свойства (молекулярный вес, структура, pH – и температурная стабильность) внеклеточных амилаз и протеаз мутанта B. subtilis 9 сопоставимы с таковыми ферментами, полученными из штаммов аналогичного бактериального вида [21, 22]. Полученные нами гидролазы бациллярного штамма, характеризующегося функциональными свойствами, в гомогенном состоянии позв олят в дальнейшем сделать заключение о потенциале их использования при создании добавок к корму сельскохозяйственных животных. Заключение. В результате многостадийной очистки с применением фракционирования сульфатом аммония, анионионоб-менной и гель-фильтрационной хроматографии из культуральной жидкости мутантного штамма B. subtilis 9 получены ферменты гидролитического действия, а именно, протеаза и амилаза. Нами изучены физико-химические характеристики указанных ферментов. Установлено, что протеаза мутанта представляла собой фермент с мономерным строением, состоящий из одной субъединицы и имеющий молекулярный вес ~44,0 кДа, тогда как амилаза являлся гомодимерным белком с двумя одинаковыми субъединицами и массой ~156,0 кДа. Ферменты характеризовались pH-и температурным устойчивостью, что открывает определенные перспективы их дальнейшего применения при разработке кормовых добавок для животноводства. Список литературы: 1. Pham J.V., Yilma M.A., Feliz A. et al. A review of the microbial production of bioactive natural products and biologics. Front. Microbiol. 2019; (10): 1404-1431. 2. Мухаммадиев Р.С., Мухаммадиев Р.С., Валиуллин Л.Р. [и др.]. Оптимизация параметров совместного культивирования Bacillus subtilis GA27 и Bacillus subtilis RF-45 для возможности создания пробиотиков, метапробиотиков и ме-табиотиков для птицеводства. Ветеринария Кубани. 2023; (3): 32-38. 3. Чиркова В.Ю., Щербаков Д.Н., Колосов П.В. [и др.]. Получение ?-ами-лазы Bacillus amyloliquefaciens в экспрессионной системе Bacillus mojavensis и свойства рекомбинантного фермента. Биотехнология. 2024; (40 (1): 42-50. 4. Мухаммадиев Р.С., Валиуллин Л.Р., Мухаммадиев Р.С. [и др.]. Оптимизация состава питательной среды пробиотического штамма B. subtilis GA24 - продуцента кормовых ферментов. Ученые записки Казанской академии ветеринарной медицины им. Н.Э. Баумана. 2022; (250 (2): 155-159. 5. Singh R., Kumar M., Mittal A. et al. Microbial enzymes: industrial progress in 21st century. 3 Biotech. 2016; (6 (2): 174-189. 6. Robinson P.K. Enzymes: principles and biotechnological applications. Essays Biochem. 2015; (59): 1-41. 7. Mokrani S., Nabti E.H. Recent status in production, biotechnological applications, commercial aspects, and future prospects of microbial enzymes: A comprehensive review. Int. J. Agric. Sc. Food Technol. 2024; (10 (1): 006-020. 8. Mukhammadiev R., Valiullin L., Mukhammadiev R. et al. Increasing the productivity of hydrolase producers by induced mutagenesis and their comparative characteristics. BIO Web of Conferences. 2024; (130): 06014. 9. Bugoni M., Takiya C.S., Grigoletto N.T.S. et al. Feeding amylolytic and proteolytic exogenous enzymes: Effects on nutrient digestibility, ruminal fermentation, and performance in dairy cows. J Dairy Sci. 2023; (106 (5): 3192-3202. 10. Singh A.K., Tiwari U.P., Berrocoso J.D. et al. Effects of a combination of xylanase, amylase and protease, and probiotics on major nutrients including amino acids and non-starch polysaccharides utilization in broilers fed different level of fibers. Poult Sci. 2019; (98 (11): 5571-5581. 11. Valiullin L.R., Mukhammadiev R.S., Mukhammadiev R.S. et al. Obtaining stable strains of microorganisms with increased production of hydrolytic enzymes by methods of induced mutagenesis and their characteristics. BIO Web of Conferences. 2024; (105): 06007. 12. Мухаммадиев Р.С., Мухаммадиев Р.С., Каримуллина И.Г. [и др.]. Ферментативная активность гидролаз штаммов микроорганизмов, перспективных для создания на их основе кормовых добавок и биологических консервантов. Сборник научных трудов национальной научно-практической конференции: Состояние, проблемы и перспективы развития современной науки. Брянск: БГАУ, 2021: 127-133. 13. Mukhammadiev R.S., Skvortsov E.V., Valiullin L.R., et al. Isolation, purification, and characterization of a lectin from the fungus Fusarium solani 4 Applied Biochemistry and Microbiology. 2021; (57 (2): 206-211. 14. Sisa A., Sotomayor C., Buitron L. et al. Evaluation of by-products from agricultural, livestock and fishing industries as nutrient source for the production of proteolytic enzymes. Heliyon. 2023; 9 (10): e20735. 15. Валиуллин Л.Р., Мухаммадиев Р.С., Мухаммадиев Р.С. [и др.]. Выделение, очистка и изучение физикохимических свойств ксиланазы штамма Bacillus subtilis 9. Достижения науки и техники АПК. 2021; (35 (10): 66-71. 16. Mukhammadiev R., Valiullin L., Tarasova E. et al. Characteristics of properties of carbohydrase enzyme complexes Bacillus subtilis strain. BIO Web of Conferences. 2024; (130): 02006. 17. Pham V.H.T., Kim J., Shim J. et al. Purification and characterization of strong simultaneous enzyme production of protease and ?-amylase from an extremophile - Bacillus sp. FW2 and its possibility in food waste degradation. Fermentation. 2022; (8 (1)): 12-25. 18. Aladejana O.M., Oyedeji O., Omoboye O. et al. Production, purification and characterization of thermostable alpha amylase from Bacillus subtilis Y25 isolated from decaying yam (Dioscorea rotundata) tuber. Notulae Scientia Biologicae. 2020; (12(1): 154-171. 19. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; (227 (5259): 680-685. 20. Сердюк Е.Г., Исакова Е.П., Гесслер Н.Н. [и др.]. Активность нейтральной фитазы из Obesumbacterium proteus в рекомбинантных штаммах дрожжей Yarrowia lipolytica при культивировании на низкосортных растительных субстратах. Прикладная биохимия и микробиология. 2019; (55 (5): 498-505. 21. Setyorini E., TakenakaS., Murakami S., et al. Purification and characterization of two novel halotolerant extracellular protease from Bacillus subtilis strain FP-133. Biosci. Biotechnol. Biochem. 2006; (70): 433-440. 22. Najafi M.F., Deobagkar D., Deobagkar D. Purification and characterization of an extracellular alpha-amylase from Bacillus subtilis AX20. Protein Expr. Purif. 2005; (41 (2): 349-354. Сведения об авторах: Валиуллин Ленар Рашитович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; заведующий отделения биотехнологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-950-9698469; е-mail: valiullin27@mail.ru. Мухаммадиев Ринат Салаватович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Галеева Антонина Глебовна, кандидат ветеринарных наук, ведущий научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-897-2338616; е-mail: antonina-95@yandex.ru. Зайнуллин Ленар Ильгизарович, кандидат биологических наук, ведущий научный сотрудник отделения биохимии и молекулярно-генетического анализа ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел. 8-843-2395320; е-mail: lenarilgizayn@mail.ru. Нестерова Ирина Александровна, соискатель, младший научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-962-5501761; е-mail: ircha-@mail.ru. Самсонов Андрей Иванович, кандидат биологических наук, ведущий научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел. 8-950-3167638; е-mail: andreykaz82@yandex.ru. Фазулзянов Ильшат Рафаилевич, кандидат биологических наук, научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел. 8-950-316-5677; е-mail: fazulrif@mail.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, старший научный сотрудник прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; е-mail: tashir9891@mail.ru. Заявленный вклад авторов: Валиуллин Л.Р.: разработка концепции, научное руководство, разработка методологии, предоставление ресурсов. Мухаммадиев Риш.С.: написание черновика рукописи, административное руководство исследовательской работой, проведение исследования. Мухаммадиев Рин.С.: написание рукописи – редактирование, проведение исследования. Галеева А.Г.: курирование данных. Зайнуллин Л.И.: формальный анализ. Нестерова И.А.: визуализация. Самсонов А.И.: валидация результатов. Фазулзянов И.Р.: проведение исследования. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|