|
||||

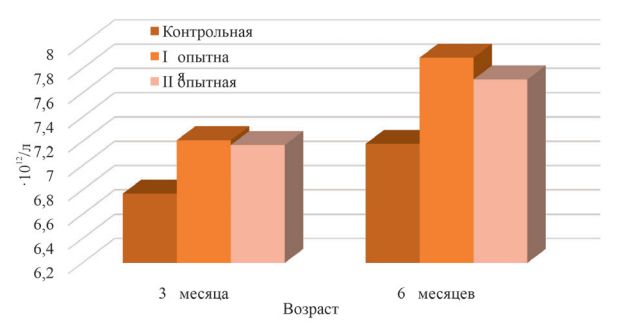
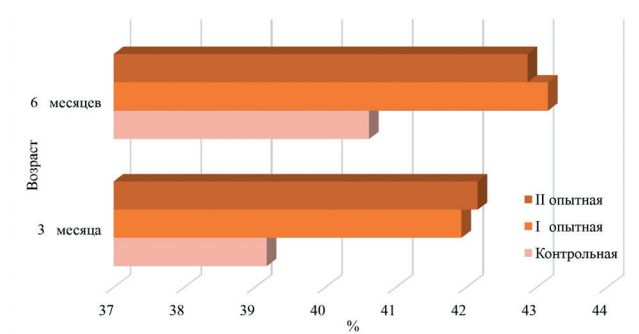
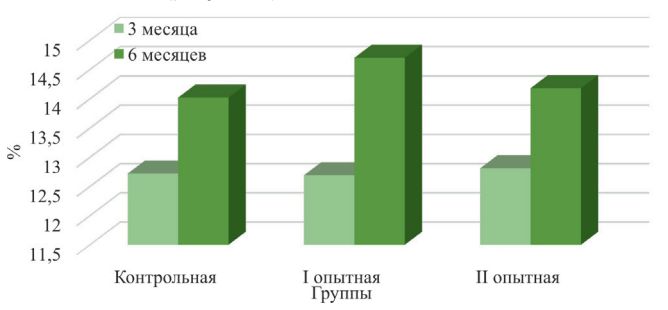
Морфологический состав крови и иммунологические показатели организма животных при применении пробиотического препаратаУДК 619.636.2.033 Оригинальное эмпирическое исследование Топурия Л.Ю. Федеральное государственное бюджетное образовательное учреждение высшего образования Аннотация. В современных условиях ведения животноводства для повышения продуктивного потенциала сельскохозяйственных животных и птиц широкое применение находит использование кормовых добавок различного происхождения, которые способствуют улучшению усвояемости питательных веществ рациона, снижению затрат кормов на производство животноводческой продукции, улучшению качества и безопасности получаемых продуктов. Ассортимент кормовых добавок на отечественном рынке достаточно велик и разнообразен. Наиболее перспективным направлением ветеринарной медицины и зоотехнии является разработка, изучение и внедрение в производство препаратов симбионтной микрофлоры. Пробиотики содержат в своём составе представителей нормальной микрофлоры кишечного тракта, положительно влияют на макроорганизм, нормализуют пищеварение, снижают заболеваемость молодняка, обладают иммуностимулирующей активностью, являются альтернативой применения антимикробных средств в отраслях животноводства. Изучено влияние разных доз пробиотика моноспорин на морфологический состав крови, факторы естественной резистентности, клеточный и гуморальный иммунитет телят. Было сформировано три группы суточных телят. Молодняк опытных групп получал пробиотик в дозе 4,0 мл и 6,0 мл один раз в день. Установлено, что применение препарата способствует повышению в крови животных в 6-месячном возрасте эритроцитов на 7,39-9,89%, гемоглобина – на 3,55-5,38%. Наблюдается усиление фагоцитарных свойств лейкоцитов: фагоцитарной активности – на 5,54-6,26%, фагоцитарного индекса – на 9,22-11,27%. Улучшились показатели ли-зоцимной и бактерицидной активности сыворотки крови, увеличилось число иммунокомпетентных клеток. Количество циркулирующих иммунных комплексов у животных под влиянием пробиотика не изменилось. Ключевые слова: телята, пробиотик, кровь, иммунитет, естественная резистентность, форменные элементы. Важной задачей сельскохозяйственного комплекса страны является увеличение производства продуктов животноводства для более полного удовлетворения потребностей населения в качественной пищевой продукции. Многие технологические процессы (транспортировка животных, отъем, вакцинации) оказывают негативное воздействие на организм. В результате этого нарушается обмен веществ, развиваются иммунодефицитные состояния и как следствие наблюдается снижение продуктивности и состояния здоровья сельскохозяйственных животных и птиц [4, 18]. Из множества лекарственных средств и кормовых добавок, обладающих иммуностимулирующей активностью, улучшающих процессы метаболизма, все большее внимание ученых и практиков привлекают препараты природного происхождения [2, 5, 7, 8]. Последние по сравнению с синтетическими аналогами имеют множество преимуществ: обладают низкой токсичностью, активизируют функции эндокринной и нервной системы, стимулируют процессы регенерации, снижают последствия стрессов [3, 19, 22]. Особого внимания заслуживают пробиотические препараты [12, 17]. Всемирная организация здравоохранения (ВОЗ) определяет пробиотики как живые микроорганизмы, при введении которых в адекватном количестве оказывают позитивный эффект на здоровье организма-хозяина [21]. Пробиотики улучшают работу желудочно-кишечного тракта за счет нормализации микробиома кишечника, повышают усвоение питательных веществ корма, подавляют деятельность патогенной и условно-патогенной микрофлоры. Под действием пробиотических препаратов в организме хозяина синтезируются метаболиты, участвующие в поддержании гомеостаза. Микроорганизмы пробиотиков продуцируют медиаторы норадреналин, адреналин, ацетилхолин, гамма-аминомасляную кислоту, а также витамины и аминокислоты. Многие пробиотики обладают иммуностимулирующей активностью [14, 20, 23]. Пробиотические препараты широко применяются в различных отраслях животноводства с лечебно-профилактическими целями и для повышения продуктивности животных и птиц [6, 10, 13]. Цель исследования – изучить морфологический состав крови и иммунологические показатели организма телят при применении пробиотика моноспорин. Для проведения опыта в условиях фермерского хозяйства Оренбургской области было сформировано три группы суточных телят красной степной породы (n=11). Представителям I опытной группы выпаивали моноспорин один раз в сутки в количестве 4,0 мл. Телятам II опытной группы пробиотик использовали в дозе 6,0 мл. Молодняк контрольной группы препарат не получал. В 3- и 6-месячном возрасте отбирали пробы крови для лабораторных исследований. В цельной крови и сыворотке оценивали морфологический состав и иммунологические показатели [1, 16]. Цифровой материал обработан статистически с использованием программы SPSS 22. Моноспорин – пробиотический препарат, представляет собой суспензию бежевого цвета, содержит спорообразующие бактерии Bacillus subtilis 945. Кровь представляет собой внутреннюю среду организма, состоит из плазмы (жидкой части) и клеток. Анализ морфологического состава крови представляет собой важный элемент в диагностике болезней животных. В результате проведенных исследований установлено, что под влиянием моноспорина у телят I опытной группы в 3-месячном возрасте наблюдалось повышение в периферической крови количества эритроцитов на 6,50% по сравнению с контролем, в 6-месячном возрасте эта разница составила 9,89% (р<0,05). У телят II опытной группы показатель превысил контрольный уровень на 5,91% и 7,39% соответственно (рисунок 1).
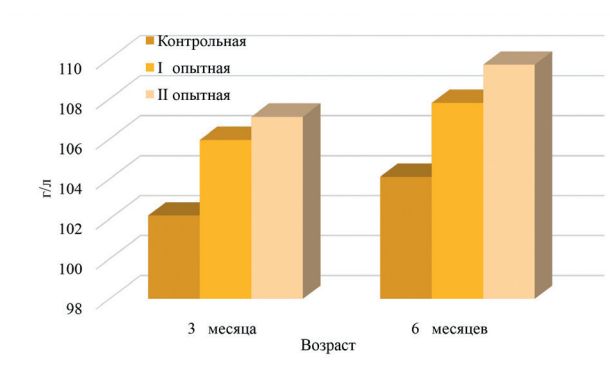
Рис. 1. Содержание эритроцитов в крови телят, 1012/л У 3-месячного молодняка крупного рогатого скота контрольной группы количество гемоглобина составило 102,17±1,42 г/л, что на 3,70% и 4,80% меньше, чем у аналогов из опытных групп. К концу наблюдений телята, получавшие пробиотик, превышали по количеству гемоглобина контрольных сверстников на 3,55% в I опытной группе и на 5,38% - во II опытной группе (рисунок 2).
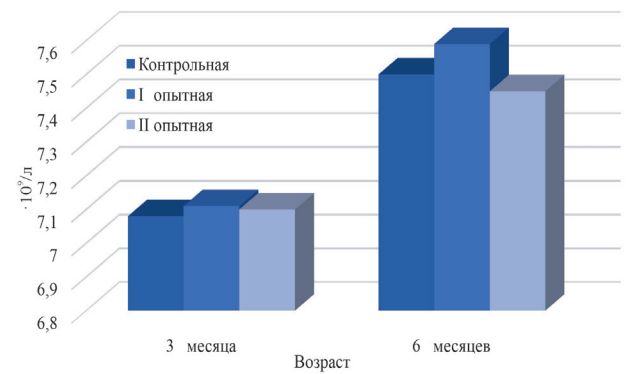
Рис. 2. Количество гемоглобина в крови телят, г/л При подсчете количества лейкоцитов не установлено значительных различий между значениями телят контрольной и опытных групп. В 3-месячном возрасте разница составила 0,030,43%, в 6-месячном – 0,66-1,20% (рисунок 3).
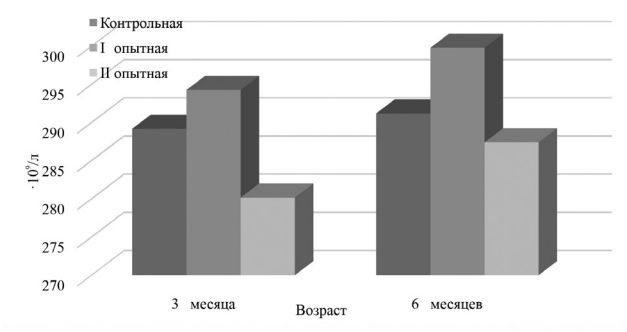
Рис. 3. Содержание лейкоцитов в крови телят, 109/л По числу тромбоцитов также не установлено существенной разницы. Так, в 3-месячном возрасте разница была в пределах 1,76-3,11%, в 6-месячном возрасте – 1,29-2,96% (рисунок 4).
Рис. 4. Содержание тромбоцитов в крови телят, 109/л Иммунная система обеспечивает поддержание генетического гомеостаза организма животных. Данный процесс осуществляется посредством факторов естественной резистентности, клеточного и гуморального иммунитета [11].
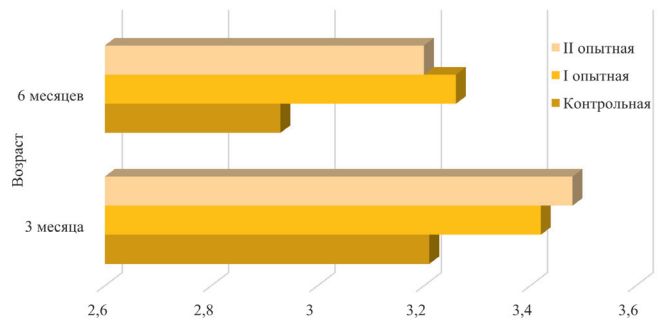
Рис. 5. Фагоцитарная активность нейтрофилов крови телят, % При оценке фагоцитарных свойств лейкоцитов крови телят установлена следующая картина. У представителей I опытной группы показатель фагоцитарной активности нейтрофилов крови в 3-месячном возрасте был выше, чем у одновозрастного контроля на 7,05% (р<0,05), в 6-месячном возрасте – на 6,26% (р<0,05). Животные II опытной группы превосходили контроль на 7,64% (р<0,05) и 5,54% соответственно (рисунок 5). Фагоцитарный индекс нейтрофилов крови был минимальным у молодняка контрольной группы во все периоды исследования – 3,21±0,03 и 2,93±0,01, что на 6,55-8,42% (р<0,05-0,01) меньше, чем у телят опытных групп в 3-месячном возрасте. К концу опыта разница увеличилась и составила 11,27% (р<0,01) в I опытной группе, 9,22% (р<0,01) – во II опытной группе (рисунок 6).
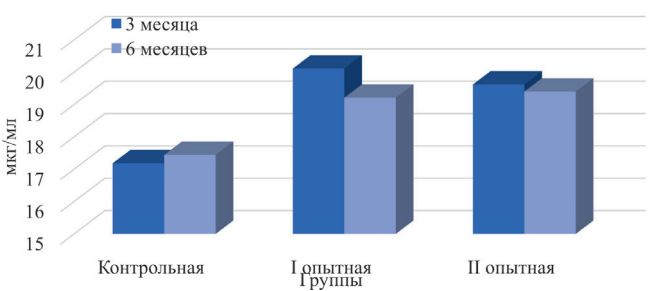
Рис. 6. Фагоцитарный индекс нейтрофилов крови телят Из гуморальных факторов естественной резистентности были изучены лизоцимная, бактерицидная и бета-литическая активность сыворотки крови животных. Максимальное значение лизоцимной активности сыворотки было установлено в 3-месячном возрасте у представителей I опытной группы – 20,11±1,42 мкг/мл, в 6-месячном возрасте – у телят II опытной группы – 19,40±1,17 мкг/мл. В целом животные контрольной группы в лизоцимной активности сыворотки уступали молодняку из опытных групп в 3-месячном возрасте на 14,21-17,06% (р<0,01), в 6-месячном возрасте – на 10,15-11,24% (р<0,01) (рисунок 7).
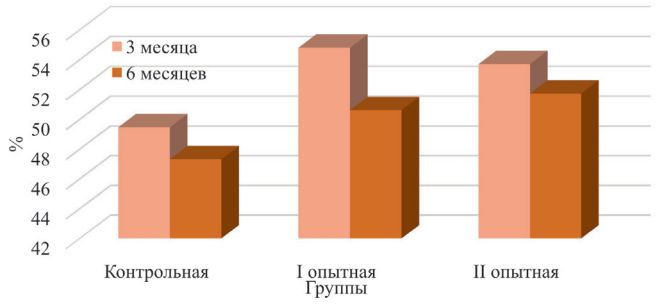
Рис. 7. Лизоцимная активность сыворотки крови телят, мкг/мл Бактерицидная активность сыворотки крови была выше у телят, получавших пробиотик в дозе 4,0 мл в 3- и 6-месячном возрасте на 10,78% (р<0,01) и 6,90% (р<0,05) по сравнению с контролем. У молодняка II опытной группы – на 8,57% (р<0,01) и 9,32% (р<0,01), соответственно (рисунок 8).
Рис. 8. Бактерицидная активность сыворотки крови телят, % Включение пробиотика моноспорин в рацион телят не сказалось заметно на бета-литической активности сыворотки крови животных, разница с контролем составила 0,23-0,71%. К 6-месячному возрасту молодняк опытных групп превосходил по изучаемому показателю контрольных сверстников на 4,85% и 1,15% соответственно (рисунок 9).
Рис. 9. Бета-литическая активность сыворотки крови телят, % Т- и В-лимфоциты являются основными клетками иммунной системы. Первые ответственны за реакции клеточного иммунитета, вторые – за гуморальный иммунитет. Пробиотик моноспорин оказал выраженный иммуностимулирующий эффект. Так, у телят I опытной группы количество Т-лимфоцитов возросло по сравнению с контролем на 7,63% (р<0,01) в 3-месячном возрасте и на 8,65% (р<0,01) – в 6-месячном. Молодняк II опытной группы превосходил контрольные значения по количеству Т-лимфоцитов, соответственно, на 8,08% (р<0,01) и на 5,86% (р<0,05) (рисунок 10).
Рис. 10. Количество Т-лимфоцитов в крови телят, % Число В-лимфоцитов минимальным было в крови телят контрольной группы и уступало значениям животных опытных групп в 3-месячном возрасте на 11,73% (р<0,01) и на 13,34% (р<0,01). В 6-месячном возрасте эта разница несколько снизилась и составила в I опытной группе 7,41% (р<0,05), во II опытной – 9,04% (р<0,01) (рисунок 11).
Рис. 11. Количество В-лимфоцитов в крови телят, % Иммунные комплексы являются физиологическим продуктом реакции антиген-антитело, являющейся частью защитных иммунных механизмов. Образование иммунных комплексов представляет собой один из компонентов нормального иммунного ответа. Однако, при избыточном накоплении циркулирующих иммунных комплексов возможен переход в сторону патологии [9, 15].
Рис. 12. Содержание циркулирующих иммунных комплексов, у.е. Существенных изменений у подопытных животных по содержанию циркулирующих иммунных комплексов не зафиксировано. Телята, которым применяли пробиотик, по данному показателю заметно не отличались от контрольных животных. Разница в 3-месячном возрасте составила 1,85-3,38%, в 6-месячном возрасте – 1,01-1,30% (рисунок 12). Заключение. Представленные результаты исследований свидетельствуют о положительном влиянии пробиотика моноспорин на морфологические показатели крови, факторы естественной резистентности, клеточный и гуморальный иммуниет. Препарат способствует повышению количества эритроцитов и гемоглобина, лизоцимной и бактерицидной активности сыворотки крови, усилению фагоцитарных свойств лейкоцитов, увеличению в крови числа Т- и В-лимфоцитов. Список литературы: 1. Афанасьева А. И. Современные методы морфологических исследований крови. 2017: 62 с. 2. Гугушвили Н. Н., Инюкина Т. А., Кощаев А. Г. [и др.]. Влияние фитоиммуномодулятора содэхина-40 и антисептика катис на общеклинические показатели крови птиц. Труды Кубанского государственного аграрного университета. 2024; (112): 225-231. 3. Гизатуллина Ф. Г., Рыбьянова Ж. С. Естественная резистентность крупного рогатого скота в условиях Южного Урала. 2020; 207 с. 4. Кавтарашвили А., Колокольникова Т. Проблема стресса и пути ее решения. Животноводство России. 2010; (6): 15-17. 5. Кавтарашвили А. Ш., Стефанова И. Л. Роль каротиноидов при комплексном обогащении пищевых яиц. Птица и птицепродукты. 2020; (3): 52-54. 6. Кожоков М. К., Кудаев Т. Р. Изучение переваримости питательных веществ комбикорма мясной птицы при добавках фосфолипида и пробиотика. Известия Кабардино-Балкарского государственного аграрного университета им. В. М. Кокова. 2024; (2): 50-58. 7. Кондручина С. Г., Семенов В. Г. Профилактика иммунодефицитного состояния и реализация биоресурсного потенциала продуктивных качеств крупного рогатого скота. Ветеринарный врач. 2024; (2): 15-23. 8. Котарев В. И., Большаков В. Н., Брюхова И. В. Влияние кормовых добавок на микробное сообщество рубцовой жидкости телят. Ветеринарный фармакологический вестник. 2021; (1 (14): 65-74. 9. Логинов С. И., Смирнов П. Н., Трунов А. Н. Иммунные комплексы у животных и человека: норма и патология. 1999: 144 с. 10. Маммаева Т. Дрожжевые пробиотики в кормлении коров. Комбикорма. 2023; (3): 43-44. 11. Михайлова Е. А., Мирошниченко И. В. Основы клинической иммунологии. 2022: 198 с. 12. Топурия Л. Ю., Топурия Г. М., Григорьева Е. В. [и др.]. Применение пробиотиков в ветеринарной медицине и животноводстве. 2016: 192 с. 13. Рудова Е. А. Обоснование применения пробиотика «МКД» в рационах супоросных и подсосных свиноматок. Эффективное животноводство. 2018; (8): 56-58. 14. Сеин О. Б., Керимов К. Б. Функционально-морфологическое состояние печени у морских свинок, получавших с рационом микрокапсулированный пробиотик Ветом 1. Вестник Курской государственной сельскохозяйственной академии. 2023; (3): 92-96. 15. Смирнов П. Н., Павлова А. И. Экологические проблемы ветеринарной медицины в Якутии. 2000:. 209 с. 16. Топурия Л. Ю., Топурия Г. М. Методы иммунологических исследований. 2024: 60 с. 17. Топурия Л. Ю., Топурия Г. М. Переваримость питательных веществ корма и состояние обмена веществ у утят при применении «Иммунофлора». Аграрная наука. 2025; (2): 67-73. 18. Тюрин В. Г., Семенов В. Г. Реализация потенциала воспроизводительных и продуктивных качеств крупного рогатого скота биопрепаратами нового поколения. Российский журнал. Проблемы ветеринарной санитарии, гигиены и экологии. 2024; (2 (50): 267-272. 19. Abudabos A. M., Okab A., Aljumaah R. S. Nutritional value of greenseaweed (Ulva lactuca) for broiler chickens. Italian Journal of Animal Science. 2012; (12 (2): 177-181. 20. Canfora E. E., Jocken J. W., Blaak E. E. Short-chain fatty acids in control of bodv weight and insulin sensitivity. Nat Rev Endocrinol. 2015; (11 (10): 577-591. 21. Hill C., Guarner F., Reid G. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nature Reviews Gastroenterology and Hepatology. 2014; (11 (8): Р. 506-514. 22. Makkar H.P.S., Tran G., Heuze V. Seaweeds for livestock diets: a review. Animal Feed Science and Technology. 2016; (212): 1-17. 23. Strandwitza P. Neurotransmitter modulation by the gut microbiota. Brain Res. 2018; (1693): 128-133. Сведения об авторах: Топурия Лариса Юрьевна, доктор биологических наук, профессор, профессор кафедры ветеринарно-санитарной экспертизы и фармакологии федерального государственного бюджетного образовательного учреждения высшего образования «Оренбургский государственный аграрный университет»; 460014, г. Оренбург, ул. Челюскинцев, 18. Лаврушина Елена Евгеньевна, кандидат биологических наук, доцент, доцент кафедры радиохимии Димитровградского инженерно-технологического института – филиала федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ»; 433511, Ульяновская область, г. Димитровград, ул. Куйбышева, 294; e-mail: lav_e_e@mail.ru. Гугушвили Нино Нодариевна, доктор биологических наук, профессор, профессор кафедры микробиологии, эпизоотологии и вирусологии федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, Краснодарский край, г. Краснодар, ул. им. Калинина, 13. Ответственный за переписку с редакцией: Топурия Гоча Мирианович, доктор биологических наук, профессор, профессор кафедры нормальной физиологии федерального государственного бюджетного образовательного учреждения высшего образования «Оренбургский государственный медицинский университет» Министерства здравоохранения Российской Федерации; 460014, Оренбургская область, г. Оренбург, ул. Советская, 6; e-mail: golaso@rambler.ru. Заявленный вклад авторов: рукопись была написана благодаря вкладу всех авторов. Все авторы одобрили окончательную версию рукописи. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|