|
||||

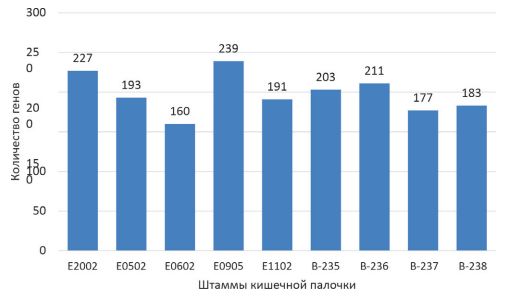
Генетическая характеристика токсигенности патогенных изолятов escherichia coli и их антибиотикочувствительностьУДК: 579.25: 619:616.98 Оригинальное эмпирическое исследование Тищенко А.С., Федорович С.В., Кощаев А.Г., Седашев А.П. Федеральное государственное бюджетное образовательное Аннотация. Токсигенные патоварианты кишечной палочки Escherichia coli играют центральную роль в развитии эшерихиоза у телят и поросят. Они способны вырабатывать специфические экзотоксины, которые нарушают нормальное функционирование кишечника, приводя к развитию тяжелых форм диареи и другим осложнениям, что негативно сказывается на благополучии животных. Наряду с широким распространением патогенных кишечных палочек особую озабоченность вызывает их антибиотикорезистентность. Цель работы – провести скрининг токсигенного генетического потенциала у изолятов E. coli, выделенных от больных телят и поросят на территории Краснодарского края, и изучить их чувствительность к антимикробным препаратам. Материалы и методы. В работе использовались 9 изолятов кишечной палочки, изучены их морфологические и культуральные свойства, проведено полногеномное секвенирование, аннотирование и сборка их геномов. С помощью дискодиффузионного метода была изучена антибиотикочувствительность выделенных изолятов к 24 антибактериальным препаратам различных фармакологических групп. Результаты исследований. Установлено большое количество генов патогенности, которое варьировало от 160 до 239. При анализе генов токсигенности было установлено, что у всех изолятов E. coli преобладали порообразующие экзотоксины в виде различных классов гемолизинов. Гены цитотонических токсинов (eltA, eltB, stb, astА) преобладали в двух штаммах, выделенных от поросят. Гены цитотоксина stx2eB выявлены у двух штаммов. Кластер генов, ответственных за выработку цикломодулина колибактина, преобладал у двух штаммов, выделенных от телят. Анализ антибиотикограммы выделенных изолятов показал их множественную устойчивость к большинству антимикробных препаратов. Из 24 проверенных антибактериальных препаратов, принадлежавших к 12 группам, у всех изолятов E. coli чувствительность сохранялась только к меропенему. Избирательную чувствительность регистрировали к амоксициллину, ампициллину, левомицетину, левофлоксацину, норфлоксацину, офлоксацину, ципрофлоксацину, цефотаксиму, амикацину. Заключение. Токсигенные штаммы кишечной палочки выступают ключевыми патогенами в возникновении эшерихиоза у телят и поросят в скотоводческих и свиноводческих хозяйствах Краснодарского края. Контроль распространения таких штаммов и новые подходы к лечению и профилактике инфицирования являются важным звеном в обеспечении здоровья и продуктивности молодняка. Ключевые слова: эшерихиоз, токсигенность, кишечная палочка, секвенирование, антибиотикорезистентность, телята, поросята. Изучение генетической характеристики патогенных штаммов кишечной палочки, которые вызывают диареегенную инфекцию у телят и поросят, имеет важное значение для ветеринарной медицины и животноводства [1, 12, 15]. Понимание генетического состава этих микроорганизмов позволяет выявить гены, отвечающие за вирулентность, токсигенность и резистентность к антибиотикам, что способствует точной диагностики и эффективному лечению инфекций. Как показывают результаты полногеномного секвенирования, выявленные на сегодняшний день диареегенные патотипы E. coli не являются статическими, вполне вероятно они пребывают в стадии динамического и продолжающегося смешивания генов вирулентности, а, следовательно, появления новых патогенных вариантов бактерий [15]. В последнее время E. coli является не только самым распространённым этиологическим агентом в развитии различных патологий у человека и животных, но и одним из наиболее антибиотикорезистентным видом [13, 20]. Особую озабоченность создаёт множественная лекарственная устойчивость E. coli, которая определяется как устойчивость к трем или более классам антимикробных препаратов [19]. При этом такие мультирезистентные бактерии обнаруживаются даже у здоровых животных. В частности, в исследовании Dimitrova et al. [8] было установлено, что 87,5% изолятов непатогенных E. coli, выделенных из фекалий здоровых свиней, находящихся на откорме, и свиного навоза из лагун, устойчивы к амоксициллину, ампициллину, тетрациклину, хлорамфениколу, триметоприм/сульфа-метоксазолу, доксициклин гидрохлориду и налидиксовой кислоте, а у некоторых обнаруживались также гены ?-лактамаз широкого спектра. Помимо этого, у энтеротоксигенных E. coli гены антибиотикоре-зистентности могут размещаться на одной конъюгативной плазмиде с генами энтеротоксинов, причём сами плазмиды легко передаются непатогенным вариантам E. coli [9, 27]. Следовательно, знание генетических особенностей штаммов E. coli в разрезе их токсигенного потенциала и антибиотикорези-стентности побуждает исследователей вести новые разработки в области создания иммунобиологических препаратов для лечения и профилактики кишечных инфекций у телят и поросят. Цель работы – изучить генетическое разнообразие факторов ток-сигенности и антибиотикорезистентности штаммов E. coli, выделенных от больных эшерихиозом телят и поросят в Краснодарском крае. Материалы и методы исследований. Исследования проводили на базе лаборатории микробиологии Центра биотехнологий и Центра молекулярно-генетических исследований Федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный аграрный университет имени И.Т. Трубилина». Выделение и идентификация штаммов E. coli проводились в соответствии с бактериологическим методом, рекомендованным Приказом об унификации методов микробиологических исследований № 535 от 1985 года. Также использовали Методические указания по бактериологической диагностике колибактериоза (эшерихиоза) животных Департамента ветеринарии МСХ и продовольствия РФ 27.07.2000 N 13-7-2/2117 и Методические указания по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями Департамента ветеринарии МСХ и продовольствия РФ № 13-7-2/1759 11.10.1999. Культивирование штаммов E. coli проводили на питательной среде LB Agar (Lennox, Laboratorios Conda, Испания). Для получения 24-часовой культуры каждого штамма инкубирование питательных сред проводилось в термостате Binder FD53 (Германия) при температуре 37°C. Контрольная идентификация микроорганизмов осуществлялась с использованием системы для масс-спектрометрического анализа «АЛМАСС Био 200» (Альгимед Техно). В работе использовали 5 штаммов, выделенных от больных эшерихиозом телят (Е0202, Е0502, Е0802, Е1102, B-238) и 4 штамма – от поросят (Е0905, B-235, B-236, B-237). Штаммы B-235, B-236, B-237, B-238 депонированы Коллекцией эубиоти-ческих и эпифитных микроорганизмов (СЕЕМ) в Центре биотехнологий Кубанского ГАУ. Выделение ДНК проводили с использованием лизирующего буфера на основе ЦТАБ [7]. Полногеномное секвенирование исследуемых изолятов проводили на приборе MiSeq («Illumina Inc», США), сборки ридов de novo на основе алгоритмов SPAdes v.4.0.0 [22] с использованием функции «careful». Обрезку адаптерных последовательностей проводили с использованием Trimmomatic [6] Качество сборки проверяли с использованием Checkm2. Аннотацию генома по факторам вирулентности проводили с использованием инструмента ABRicate. Для визуализации данных использовали RStudio – Build 394 [21], с пакетами ggplot2 и dplyr. Определение чувствительности к антибиотикам проводилось в соответствии с клиническими рекомендациями «Определение чувствительности микроорганизмов к противомикробным препаратам» Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (MACMAX, версия 2024-02; EUCAST, Clinical Breakpoint Tables v. 15.0, valid from 2025-01-01). Использовались противомикробные препараты: азитромицин (15 мкг), амикацин (30 мкг), амоксициллин/клавулановая кислота (20/10 мкг), ампициллин (10 мкг), ванкомицин (30 мкг), гентамицин (10 мкг), доксициклин (30 мкг), имипенем (10 мкг), колистин (300 ед), левомицетин (30 мкг), левофлоксацин (5 мкг), линезолид (30 мкг), меропенем (10 мкг), норфлоксацин (10 мкг), оксациллин (1 мкг), офлоксацин (5 мкг), рифампицин (5 мкг), тетрациклин (30 мкг), тилозин (15 мкг), фурадонин (300 мкг), цефотаксим (30 мкг), цефтриаксон (30 мкг), цефуроксим (30 мкг), ципрофлоксацин (5 мкг), эритромицин (15 мкг). Инокулят каждого штамма выращивали на агаре Мюллера-Хинтона (Himedia, Мумбаи, Индия), и на поверхность агара помещали соответствующие диски, пропитанные лекарственным препаратом. Индекс MAR (множественной антибиотикорезистентности) определяли как отношение количества антибиотиков, к которым, была обнаружена устойчивость тестируемых штаммов кишечной палочки, к общему количеству антибиотиков, использованных для оценки чувствительности. Индекс MAR более 0,2 указывает на биологическую среду, подверженную высокому риску заражения и использования антибиотиков. Установленные данные оформляли в графический и табличный материал с использованием программ Microsoft Office Word и Excel 2010. Результаты исследований и их обсуждение. В ходе проведенного полногеномного анализа изолятов кишечной палочки и скрининга их патогенного потенциала установили, что наибольшее количество генов, отвечающих за их вирулентность, обнаружено у Е0905, выделенного от инфицированного поросенка – 239 генов (рисунок 1). На втором месте находился изолят Е0202, выделенный из патологического материала больного теленка. У остальных штаммов количество генов патогенности варьировало от 160 до 211.
Рис. 1. Количество генов, ответственных за патогенность у E. coli, выделенных от больных телят и поросят При анализе генов токсигенности было установлено, что у всех изолятов преобладали порообразующие экзотоксины в виде различных классов гемолизинов (табл. 1). Наиболее полно этот кластер генов представлен у штаммов Е0202, B-236, B-237, B-238. Генетические последовательности цитотонических токсинов (eltA, eltB, stb, astА) регистрировали у штаммов B-235 и B-236. В штаммах B-237 и B-238 помимо кластера гемолизинов содержались гены цитотоксического экзотоксина stx2eB. В изоля-тах Е0202 и Е1102 преобладал генетический кластер колибакти-на, относящийся к цикломодулинам. Определение антибиотикорезистентности выделенных штаммов показало их устойчивость к широкому спектру лекарственных Таблица 1 Генетическое разнообразие факторов токсигенности у штаммов E. coli, выделенных от больных телят и поросят
Таблица 2 Генетическое разнообразие факторов токсигенности у штаммов E. coli, выделенных от больных телят и поросят
Примечание: R – резистентен (устойчив) к антимикробным препаратам; S – чувствителен к антимикробным препаратам. препаратов (табл. 2). Из 24 проверенных антибактериальных препаратов, принадлежавших к 12 группам, у всех изолятов чувствительность сохранялась только к меропенему. Избирательную чувствительность регистрировали к антибиотикам пенициллинового ряда – амоксициллин и ампициллин; фениколам – левомицетин; фторхинолонам – левофлоксацин, норфлоксацин, офлоксацин, ципрофлоксацин; цефалоспоринам III поколения (цефотаксим); аминогликозидам (амикацин). Также был определён индекс множественной устойчивости к антибиотикам (MAR), как инструмент для оценки рисков для здоровья и благополучия. Этот индекс полезен для отслеживания распространения бактериальной резистентности в определённой популяции, где наблюдается устойчивость более чем к трём антибиотикам [20]. Индекс множественной устойчивости у всех изолятов кишечной палочки находился в пределах 0,71–0,96. Это указывает, что в популяции микроорганизмов преобладают штаммы, которые устойчивы сразу к нескольким классам антибиотиков. Обсуждение результатов исследований. Патогенный потенциал кишечных палочек представлен факторами адгезии, колонизации, экзотоксинообразованием. Их перечень разнообразен, но особая роль отводится токсигенности, поскольку с ней связаны клиническое проявление и исход болезни [1, 11, 12, 15]. В результате данного исследования также показано проявление генетического разнообразия генов токсигенности у изолятов кишечной палочки. Выявлены гены токсинов различных групп. Гемолизины принадлежат к классу ?-PFТ и входит в семейство RTX токсинов. [24]. Продукт гена hlyA представляет собой белок, являющийся предшественником зрелого гемолизина А, способного к образованию пор. Продукт гена hlyC участвует в посттрансляционной модификации токсина. Гены hlyB и hlyD кодирую белки участвующие в транспорте токсина из бактериальной клетки [23, 24, 26]. Schwidder с соавторами [23] приводит сведения о распространении гена hlyA у различных изолятов E. coli. Как оказалось, частота регистрации hlyA-позитивных E. coli среди клинических изолятов, выделенных от человека и продуктивных животных, а также пищевых продуктов колеблется в диапазоне от 12 до 96 %. Токсин HlyE вызывает гемолиз эритроцитов и влияет на передачу сигналов Ca2+ у эпителиальных клеток кишечника. Установлено, что полноценным геном hlyE обладают до 80 % патогенных E. coli. Экспрессия CylA активизируется и становится фенотипически проявляемой (наличие гемолиза) при перепроизводстве транскрипционного регулятора SlyA, который присутствует только у патогенных штаммов. SlyA сам по себе проявляет цитотоксическую активность, опосредуя апоптоз макрофагов и способствуя бактериальной инвазии [26]. Термолабильный токсин (ген eltAB), расположены на большой плазмиде pEnt, которая может передаваться непатогенным E. coli, превращая их в патогенные. LT подразделяется на 2 варианта – LT-I и LT-II. Первый имеет 2 субварианта – LT-Ih (человеческий) и LT-Ip (свиной), которые не только обуславливают развитие диареи, но и улучшают адгезию ЕТЕС к кишечному эпителию. В полевых условиях LT-II чаще всего вызывает диарею у телят, хотя его гены были обнаружены у E. coli, выделенной также от буйволов, поросят, страусов. В лабораторных условиях очищенные LT-IIa и LT-IIb приводили к развитию тяжелой диареи у новорожденных поросят [11]. У животных LT-положительная E. coli обычно продуцирует фимбрии F4 и STb, что указывает на возможную функциональную связь между этими факторами вирулентности. Установлено, что при одновременном присутствии LT и ST происходит увеличение поступления воды в просвет кишечника сверх уровней, наблюдаемых под воздействием только одного из токсинов [12]. Установлено, что STb может проникать вглубь тканей кишечника, используя трансклеточный проход путем формирования в клетках неспецифических пор за счет олигомеризации. Под действием STb наблюдается снижение всасывающей способности слизистой оболочки кишечника по причине гибели поглощающих клеток и уменьшения высоты их ворсинок. У поросят под влиянием STb площадь поверхности слизистой оболочки кишечника сокращалась на 20% по сравнению со здоровыми сверстниками [15]. Ген EAST1 (термостабильный токсин энтероаггрегативной E. coli) встречается примерно у 40 % штаммов энтероаггрегатив-ной E. coli, изолированных от человека, у 22,7–53,3 % – от поросят и около 50 % – от телят [11]. В настоящее время установлено, что геном EAST1 могут также обладать изоляты отнесённые к эн-терогеморрагической, энтеротоксигенной, диффузно-адгезивной и энтеропатогенной E. coli и даже другие энтеробактерии (например, сальмонеллы и клебсиеллы) [18]. Установлено, что почти все F4-положительные штаммы E. coli, выделенные от поросят с диареей были также EAST1-положительными. Поскольку фимбрия F4 является основным адгезином энтеротоксигенных E. coli свиного происхождения, предполагается, что EAST1 также может быть маркером вирулентности для изолятов кишечной палочки, выделяемых от поросят с диареей. В связи с этим предполагают, что сам по себе EAST1 не способен обуславливать развитие диареи, но при взаимодействии с другими токсинами, и, в частности с STa или LT, инициирует развитие профузного поноса [11]. Семейство включает два типа токсинов – Stx1 и Stx2, при этом Stx1 имеет 3 подтипа (a, c, d), а Stx2 – 9 подтипов (a, в, с, d, e, f, g, h, i) определяющиеся нуклеотидными различиями, биологической активностью и серологической неоднородностью. Поскольку подтипы Stx2 в большей степени отличаются между собой, чем подтипы Stx1, они показывают и разные уровни токсичности и разные предпочтения в выборе рецепторов [18]. В нашем случае были выделены изоляты с генами STX 2e, которые играют основную роль в возникновении постотъемной диареи у поросят [17]. Как показали исследования, цикломодулины могут продуцировать ряд патогенных бактерий, в том числе кишечная палочка, которые могут нарушать клеточный цикл клеток-хозяев, а, следовательно, изменяющие их основные функции. В настоящее время установлено, что колибактин могут продуцировать также кишечные E. coli и ряд других энтеробактерий. Особенность действия колибак-тина на эукариотическую клетку заключается в индукции разрыва двухцепочечной ДНК и хромосомных перестроек, что приводит к старению, апоптозу или неконтролируемому делению клетки [14]. Несмотря на выраженные патогенные свойства колибакти-на, имеются сведения и о его возможно полезном для организма действии. Например, у пробиотического штамма E. coli Nissle 1917 имеется геномный участок pks, с которым связывают его противовоспалительное действие при колите, поскольку pks контролирует синтез противовоспалительных соединений и обезболивающего липопептида, которые способны проникать через эпителиальный барьер и ингибировать кальциевые каналы, что снижает висцеральную чувствительность [10]. Наряду с распространением патогенных кишечных палочек и факторов их токсигенности, особую озабоченность вызывает их антибиотикорезистентность. Нами, при определении чувствительности у клинических изо-лятов E. coli, выделенных от больных диареями новорожденных телят в хозяйствах Краснодарского края к различным препаратам, используемых в ветеринарии и представляющих основные группы антибактериальных веществ (пенициллины, цефалоспорины, аминогликозиды, тетрациклины, макролиды, левомицитин, производные фторхинолона, 8-оксихинолина, хиноксалина, сульфаниламида, нитрофурана) было установлено, что резистентыми к 10 и более препаратам было 33,2 % штаммов, а всего мультирезистентных – 95,3 %. От 70 до 100 % изученных штаммов были резистентны к стрептомицину, апрамицину, хлортетрациклину, тилану, диоксидину и этазолу. При этом также было установлено, что чувствительность E. coli к фурацилину и фуразолидону за 40-летний период их использования в отечественной ветеринарии снизилась в 6–10 раз [25]. Аналогичные исследования, проведенные у нас в стране показали, что количество резистентных форм E. coli при длительном использовании антибиотиков в свиноводстве и скотоводстве существенно увеличилось. Так к ампициллину, пенициллину, карбе-нициллину, цефалексину, цефазолину, эритромицину, олеандоми-цину, тетрациклину, доксициклину, канамицину, стрептомицину, неомицину, линкомицину и рифампицину резистентными оказались 70,6–98,1 % изолятов [5]. С. А. Макавчик [2] отмечает, что в последнее время большинство (70–100 %) культур E. coli, выделенных от крупного рогатого скота с различными инфекционно-воспалительными заболеваниями, были чувствительны к неомицину, гентамицину, тетрациклину, доксициклину и ципрофлоксацину, но в тоже время проявляли резистентность к ампициллину, амоксициклину, эритромицину, азитромицину, клиндамицину, линкозамину и цефалексину [3]. Соответствующие данные были получены и в других странах. Высокие уровни устойчивости к антибиотикам (от 50 до 100 % к 5 и более препаратам) были зарегистрированы у E. coli, изолированных от больных свиней и телят в Бельгии, Польше, Испании, Германии, Франции, Швеции (20 %) [8, 9, 19, 27]. Значительное распространение антибиотикорезистентности у изолятов E. coli, выделенных от поросят с постотъемной диареей, было зафиксировано в Австралии и Малазии. До 100 % этих изолятов оказались устойчивыми к стрептомицину, спектиноми-цину, ампициллину, тетрациклину, налидиксовой кислоте, амоксициллину, хлорамфениколу и триметоприм-сульфаметоксазолу. В меньшем количестве было устойчиво к неомицину, апрамицину и гентамицину. В тоже время ни один из изолятов не был устойчив к энрофлоксацину или цефтиофуру [16]. При исследовании чувствительности патогенной E. coli, выделенной от поросят-отъемышей с диареей в Корее было установлено, что 90,7 % изолятов обладали мультирезистентностью к лекарственным средствам. Наибольшее количество резистентных изолятов было к хлорамфениколу (88,1 %), тетрациклину (86,4 %), стрептомицину (86,4 %), ампициллину (86,4 %), гентамицину (77 %), триметоприм-сульфаметоксазолу (75,7 %), амоксициллину (75,7 %), и энрофлоксацину (64,9%) [17]. Заключение. Патогенные E. coli, обладая способностью продуцировать различный спектр токсоидных структур, имеют широкое распространение в скотоводческих и свиноводческих комплексах Краснодарского края, и могут обусловливать целый ряд патологических изменений в организме телят и поросят. В свою очередь, устойчивость к противомикробным препаратам является серьезной и растущей мировой проблемой в ветеринарии, что связано глобальным применением антибиотиков и химиопрепаратов практически при любой патологии, как с лечебной, так и профилактической целью, а также с целью контроля над инфекцией и повышения интенсивности роста. Эти обстоятельства следует учитывать при организации терапевтических и профилактических мероприятий в отношении эшерихиоза и других инфекций животных. Исследование выполнено при финансовой поддержке Кубанского научного фонда в рамках научного проекта за счет гранта Российского научного фонда № 25-16-20069 «Разработка отечественного биологического иммуностимулятора на основе экзометаболитов кишечной палочки и научно-практическое обоснование его использования в промышленном скотоводстве и свиноводстве». Список литературы: 1. Генетический потенциал токсигенных Escherichia coli, выделенных от телят и поросят / А. С. Тищенко, А. Г. Кощаев, А. В. Милованов [и др.] // Аграрный вестник Урала. 2024; (2 (8): 1071–1081. 2. Макавчик, С. А. Распространение на животноводческих фермах Escherichia coli, синтезирующих бета-лактамазы расширенного спектра / С. А. Макавчик, Н. В. Полищук // Нормативно-правовое регулирование в ветеринарии. 2022; (2):44-48. 3. Механизмы резистентности к антимикробным препаратам у микроорганизмов, выделенных от крупного рогатого скота / С. А. Макавчик, А. Л. Кротова, Ж. Е. Баргман [и др.] // Вопросы нормативно-правового регулирования в ветеринарии. 2020; (4):41-46. 4. Проблемы антибиотикотерапии энтеротоксигенного эшерихиоза телят и поросят и пути их решения / А. С. Тищенко, А. Г. Кощаев, П. П. Яковенко [и др.] // Ветеринария Кубани. 2022; (3):8–11. 5. Чувствительность к антибактериальным препаратам энтеробактерий, выделенных при желудочнокишечных болезнях животных / Е. М. Ленченко, Чжун Синь, Е. А. Мансурова, И. И. Тарасова // Аграрная наука. 2014; (9): 30–32. 6. Bolger, A. M., Lohse, M., & Usadel, B. (2014). Trimmomatic: A flexible trimmer for Illumina Sequence Data. Bioinformatics, btu170. 7. de Brito O. A. et al. Comparing protocols of DNA extraction from Escherichia coli: Analysis of purity and concentration by gel electrophoresis //Baghdad Journal of Biochemistry and Applied Biological Sciences. 2022; (3 (02):133-144. 8. Dimitrova L.; Kaleva, M.; Zaharieva, M.M.; Stoykova C., Tsvetkova I. et al. Prevalence of Antibiotic-Resistant Escherichia coli Isolated from Swine Faeces and Lagoons in Bulgaria // Antibiotics. 2021; (10):940. 9. Do K.H., Byun J.W., Lee W.K. Virulence genes and antimicrobial resistance of pathogenic Escherichia coli isolated from diarrheic weaned piglets in Korea // J. Anim. Sci. Technol. 2020; (62(4):543–552. 10. Dubbert S., Klinkert B., Schimiczek M., Wassenaar T.M., von Bunau R. No Genotoxicity Is Detectable for Escherichia coli Strain Nissle 1917 by Standard In Vitro and In Vivo Tests // Eur. J. Microbiol. Immunol. 2020; (10(1):11–19. 11. Dubreuil J.D. EAST1 toxin: An enigmatic molecule associated with sporadic episodes of diarrhea in humans and animals // J Microbiol. 2019; (57(7):541–549. 12. Dubreuil J.D. Escherichia coli STb toxin and colibacillosis: Knowing is half the battle // FEMS Microbiol. Lett. 2008; (278(2):137–145. 13. Fair R. J. and Y. Tor Antibiotics and Bacterial Resistance in the 21st Century // Perspectives in Medicinal Chemistry. 2014; (6):25–64. 14. Fais T., Delmas J., Barnich N., Bonnet R., Dalmasso G. Colibactin: More Than a New Bacterial Toxin // Toxins. 2018; (10(4):151. 15. Fleckenstein J. M. and Kuhlmann F. M. Enterotoxigenic Escherichia coli Infections // Curr Infect Dis Rep. 2020; (21(3): 9. 16. Ho W.S., Tan L.K., Ooi P.T., Yeo C.C., Thong K.L. Prevalence and characterization of verotoxigenic-Escherichia coli isolates from pigs in Malaysia // BMC Vet Res. 2013; (9):109. 17. Kang E., Hwang S.Y., Kwon K.H., Kim K.Y., Kim J.H., Park Y.H. Prevalence and characteristics of Shiga toxin-producing Escherichia coli (STEC) from cattle in Korea between 2010 and 2011 // J Vet Sci. 2014; (15(3):369–379. 18. Lee K.-S., Jeong Y.-J., Lee M.-S. Escherichia coli Shiga Toxins and Gut Microbiota Interactions // Toxins. 2021. (13) : 416. 19. Luppi A. Swine enteric colibacillosis: diagnosis, therapy and antimicrobial resistance // Porcine Health Management. 2017; (3):16. 20. Poirel L., Madec J.-Y., Lupo A., Schink A.-K. et al. Antimicrobial resistance in Escherichia coli // Microbiol. Spectrum. 2018; (6(4):ARBA-0026-2017. 21. Posit team (2025). RStudio: Integrated Development Environment for R. Posit Software, PBC, Boston, MA. URL http://www.posit.co/. 22. Prjibelski A. et al. Using SPAdes de novo assembler // Current protocols in bioinformatics. 2020; (70.(1): e102 23. Schwidder M., Heinisch L. and Schmidt H. Genetics, Toxicity, and Distribution of Enterohemorrhagic Escherichia coli Hemolysin // Toxins. 2019; (11):502. 24. Sora V. M., Meroni G., Martino P. A., Soggiu A. et al. Extraintestinal Pathogenic Escherichia coli: Virulence Factors and Antibiotic Resistance // Pathogens. 2021; (10):1355. 25. Tishchenko A., Terekhov V., Pimenov N. and Ivannikova R. Prevention of enterotoxigenic escherichiosis as a way to stabilize the ecological situation of anthropogenic pollution by antibiotic-resistant strains // IOP Conf. Series: Earth and Environmental Science. 2022; (981):042067. 26. Wiles T. J. and Mulvey M. A The RTX pore-forming toxin ?-hemolysin of uropathogenic Escherichia coli: progress and perspectives // Future Microbiol. 2013; (8):73–84. 27. Zeineldin M., Aldridge B. and Lowe J. Antimicrobial Effects on Swine Gastrointestinal Microbiota and Their Accompanying Antibiotic Resistome // Front. Microbiol. 2019; (10):1035. Сведения об авторах: Федорович Святослав Валерьевич, научный сотрудник центра молекулярно-генетических исследований ФГБОУ ВО «Кубанский государственный аграрный университет имени И .Т. Трубилина»; 350044, г. Краснодар, ул. им. Калинина, 13; тел.: 8-918-2704727; e-mail: havok11.F@gamail.com. Кощаев Андрей Георгиевич, доктор биологических наук, академик РАН, профессор, проректор по научной работе ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-861-2215637; e-mail: koshhaev.a@kubsau.ru. Седашев Артем Петрович, лаборант лаборатории микробиологии Центра биотехнологий ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-918-0511691; e-mail: sedashevartem@mail.ru. Терехов Владимир Иванович, доктор биологических наук, профессор ГБПОУ Краснодарского края «Пашковский сельскохозяйственный колледж»; 350910, г. Краснодар, ул. Е. Бершанской, 220; тел.: 8-988-4742115; e-mail: vterekhov@list.ru. Ответственный за переписку с редакцией: Тищенко Александр Сергеевич, кандидат ветеринарных наук, заведующий лабораторией микробиологии Центра биотехнологий, доцент кафедры микробиологии, эпизоотологии и вирусологии факультета ветеринарной медицины ФГБОУ ВО «Кубанский государственный аграрный университет имени И. Т. Трубилина», 350044, Россия, г. Краснодар, ул. Калинина, 13. Тел. +79284692399, e-mail: mephisto83@inbox.ru. Заявленный вклад авторов: Тищенко А.С.: разработка методологии, визуализация, обсуждение результатов, написание черновика рукописи. Федорович С.В.: проведение секвенирования, биоинформатический анализ, валидация результатов. Кощаев А.Г.: разработка методологии, рецензирование и редактирование рукописи. Седашев А.П.: постановка антибиотикочувствительности, фиксирование полученных результатов. Терехов В.И.: разработка концепции, валидация и обсуждение результатов исследований Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|