|
||||

Частота выявления генома вируса инфекционного ринотрахеита у крупного рогатого скота при патологии воспроизводства в хозяйствах молочного направленияУДК 619:616.98:578.825.15:618.1/636.2 Котенева С.В., Семенова О.В., Глотова Т.И., Глотов А.Г. ФГБУН Сибирский федеральный научный центр агробиотехнологий Российской академии наук, Новосибирская область, пос. Краснообск Введение. Репродуктивное здоровье стада - основа экономической эффективности индустрии молочного и мясного г животноводства. Факторы, влияющие на воспроизводительные функции коров и телок, могут быть разными и варьируют от хозяйственных причин до сложного комплекса различных болезней [1, 5].
В настоящее время в Российской Федерации интенсивно развивается молочное скотоводство, что сопровождается сосредоточением большого числа высокопродуктивных животных, в том числе завезенных из других стран, на ограниченных территориях. В данной ситуации возрастает значение вирусных инфекций [2, 9]. Одной из болезней, снижающих эффективность этой отрасли, является инфекционный ринотрахеит (далее, ИРТ) - широко распространенная инфекция крупного рогатого скота, возбудителем которой является Bovine herpesvirus - 1 (BHV-1). Согласно современной классификации вирус относится к порядку Herpesvirales, семейству Herpesviridae, подсемейству Alphaherpesvirinae, роду Varicellovirus [11].
Существует один генетический тип вируса и три субтипа (1.1 -респираторные, 1.2 а/в - генитальные и 1.3 - выделенные от животных с признаками менингоэнцефалитов), различающиеся по вирулентности [14].
Респираторная форма болезни у телят в нашей стране изучена достаточно полно [3, 6, 7], однако, данных о влиянии вируса на воспроизводительные функции крупного рогатого скота недостаточно. Мало данных о частоте выявления и полиморфизме генома вируса при патологии воспроизводства крупного рогатого скота, особенно на крупных молочных комплексах.
Последствием респираторной инфекции неиммунных стельных особей является инфицирование плода и аборты, происходящие во второй стадии стельности, чаще между 4-м и 8-м месяцами. Занос вируса в неиммунное стадо животных может привести к массовым абортам, при этом могут абортировать от 25 до 60% маточного поголовья [15]. В стационарно неблагополучных хозяйствах инцидентность абортов ниже.
Наряду с респираторной распространена и генитальная форма болезни, проявляющаяся в виде пустулезного вульвовагинита у телок и коров и баланопостита у быков. Она характеризуется формированием множественных мелких узелков, везикул, фокальных некрозов и язв на воспаленных слизистых оболочках, проявляющихся «транзит-но» и самостоятельно исчезающих в течение 1-2-х недель. Аборты при данной форме болезни не происходят [12, 13].
Признаки «классического» ИРТ-ИПВ у коров, описанные в литературе, встречаются относительно редко. Как правило, течение основного заболевания сопровождается развитием секундарной инфекции [3]. Основной источник возбудителя - животные с острой формой (а также субклинически больные) и, особенно, латентно инфицированные. Поэтому опасны ситуации, когда вместе собирается скот с неизвестным статусом к вирусу ИРТ или из разных мест (на выставках, откормочных площадках, транспортировка) [3, 9, 10]. В эпизоотологии болезни большую роль играют латентно инфицированные быки-производители, распространяющие вирус через инфицированную сперму [2].
В связи с увеличением объемов завозимых в нашу страну племенных животных и животноводческой продукции возрастает опасность заноса возбудителя ИРТ крупного рогатого скота, что может привести к серьезным экономическим потерям вследствие болезни, падежа молодняка, репродуктивных проблем, проведения дополнительных ветеринарных мероприятий, ограничения международной торговли скотом.
В данной ситуации приобретает большое значение проведение мониторинга инфекционных агентов в хозяйствах с целью выбора оптимальной стратегии профилактических мероприятий и типа вакцин.
Ранее нами был разработан способ дифференциации штаммов и изолятов вируса на основе полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ-анализ) [4].
В связи с этим целью данной работы являлось изучение частоты выявления генома вируса ИРТ крупного рогатого скота у животных с наличием патологии воспроизводства в хозяйствах молочного направления при помощи полимеразной цепной реакции с последующим определением рестрикционного профиля.
Материалы и методы исследований. Исследования проводили с 2001 по 2014 годы в хозяйствах Сибири, где не осуществлялась специфическая профилактика инфекционного ринотрахеита крупного рогатого скота. В некоторые из них ввозились животные из других стран и регионов России.
При изучении распространения ИРТ крупного рогатого скота использовали результаты собственных серологических и вирусологических исследований. Высчитывали средний процент проб сыворотки крови, содержащих вируснейтрализующие антитела к вирусам, от числа поступивших из хозяйств с различной концентрацией животных, где наблюдались вспышки гинекологических заболевание животных.
Пробы биоматериала - вагинальные выделения, экссудат из матки, кусочки плаценты - отбирали от ремонтных телок случного возраста, нетелей, первотелок, коров дойных и в запуске с наличием или отсутствием видимой гинекологической патологии. От абортплодов и мертворожденных телят брали пробы головного мозга и внутренних органов.
Пробы биоматериала отбирали в объеме 1 см3, готовили 10%-ные суспензии на физиологическом растворе. ДНК выделяли с использованием комплекта реагентов «ДНК-сорб» производства ФБУН ЦНИИЭ Роспотребнадзора.
Для скрининговых серологических исследований пробы сыворотки крови отбирали от животных однократно, а для проведения ретроспективной диагностики ИРТ крупного рогатого скота - двукратно с интервалом 21-30 дней. Всего исследовали 1 173 пробы сыворотки крови.
Наличие антител в сыворотке крови животных определяли в реакции микронейтрализации в перевиваемой культуре клеток MDBK согласно стандарту МЭБ (OIE Manual, Manual of Standards//Chapter 2.3.5, 2015). Цифровые значения титров вируснейтрализующих антител указывали в логарифмах по основанию 2. При анализе полученных результатов определяли средние величины и среднеквадратическое отклонение (М ± СКО).
Молекулярные исследования проводили методом полимеразной цепной реакции с помощью тестсистемы, разработанной нами, согласно наставлению по применению, с последующим анализом полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ). Для гидролиза использовали эндонуклеазы рестрикции HpaI и SacII. Всего исследовали 588 проб биоматериала от коров и нетелей, ткани от 67 абортплодов и 56 мертворожденных телят.
Результаты и их обсуждение. При клиническом обследовании животных выявляли острые и хронические метриты и эндометриты, вульвовагиниты, аборты, рождение нежизнеспособного приплода, задержание последа, нарушение полового цикла, снижение массы тела и удоев, болезни телят.
Сервис-период по отдельным хозяйствам составлял более 130 дней, при норме 60-75 дней, а количество животных, плодотворно осемененных после первого раза, колебалось от 50 до 56,5%, второго - от 20 до 25%. В некоторых хозяйствах требовалось до 6-7-и осеменений телок.
Результаты серологических исследований, проведенных в хозяйствах Сибири, показали широкое распространение ИРТ среди крупного рогатого скота. Серопозитивность коров и нетелей к вирусу ИРТ составила в среднем по хозяйствам 72,0%.
Анализ ведения животноводства в обследованных хозяйствах выявил следующие закономерности. В мелких хозяйствах с численностью дойных коров до 500 голов и молочной продуктивностью до 4 500 л в год количество положительно реагирующих животных в стаде составило в среднем 64,2%. На молочных комплексах (от 800 голов, продуктивность 5 500 - 7 000 л в год) без завоза импортного скота уровень серопозитивности составил 68%. Вероятно, это связано с широким охватом коров искусственным осеменением, высокой молочной продуктивностью (особенно резким ее повышением), наличием стрессовых факторов, приводящих к активизации вирусов и их пассированию на естественно восприимчивых животных, что способствует повышению их вирулентных свойств. Наиболее высокий уровень серопозитивности (86,1%) отмечен у животных на крупных молочных комплексах, на которых производился завоз импортного скота. Интенсивность проявления ИРТ крупного рогатого скота зависит от концентрации животных в хозяйствах и их продуктивности, в частности, молочной. Анализ величин титров вируснейтрализующих антител к вирусу показал, что их значения повышаются в зависимости от концентрации поголовья в хозяйстве. Это свидетельствует о более широкой циркуляции вируса в таких хозяйствах и его участии в патологии репродуктивных органов у животных.
При исследовании парных проб сыворотки крови от больных животных сероконверсию, сопровождающуюся четырехкратным и более приростом титров нейтрализующих антител, выявили у 59,6% коров и нетелей при острых вспышках ИРТ КРС. Сероконверсию выявляли как у животных, поступивших по импорту, так и отечественной селекции
Результаты исследований по выявлению генома вируса ИРТ КРС в пробах биоматериала представлены в таблице 1. Таблица 1. Частота выявления генома вируса инфекционного ринотрахеита у крупного рогатого скота при патологии воспроизводства
Результаты показали, что геном вируса выявили в среднем у 26,9% абортплодов 6-8-и месячного возраста и 34% мертворожденных телят. Он присутствовал в паренхиматозных органах, а в некоторых случаях, в головном мозге. В большинстве случаев у матерей выявляли сероконверсию к вирусу после аборта. У абортированных плодов обнаруживались сильные аутолитические изменения внутренних органов, что обусловлено гибелью плодов в матке до аборта. Вирус присутствовал в 22,4% вагинальных и маточных выделений и 36,4% пробах плаценты первотелок и коров.
Учитывая циркуляцию возбудителя среди восприимчивого поголовья, большой интерес вызывает определение субтипа вируса, циркулирующего в конкретном стаде животных. Для дифференциации генома вируса нами был проведен ПЦР-ПДРФ анализ с использованием эндонуклеаз рестрикции HpaI и SacII [4].
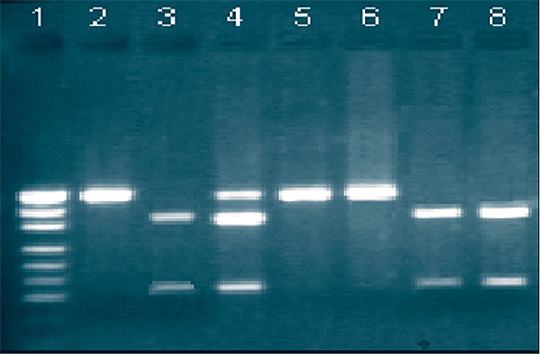
При проведении ПДРФ-анализа с помощью эндонуклеазы рестрикции SacII у вакцинного штамма ТК-А отсутствовал сайт узнавания, но эпизоотические штаммы рестриктировались этим ферментом. При проведении электрофореза трек с вакцинным штаммом после рестрикции содержал одну полосу ДНК размером 464 н.п., а эпизоотические - 2 или 3 полосы, нижние из которых соответствовали размеру 343 и 121 н.п. (рисунок 1).
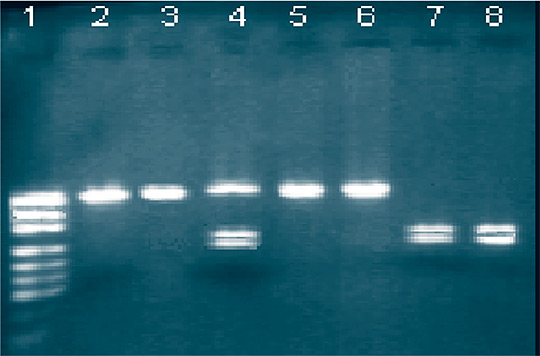
Рис. 1. ПДРФ-анализ изолятов BHV-1 при помощи эндонуклеазы SacII: 1 - маркер молекулярного веса (MspI, гидролизат плазмиды pUC19); 2 - штамм «ТК-А»; 3 - штамм «ТК»; 4 - изолят из маточных выделений коровы; 5 - изолят из вагинальных выделений коровы; 6 - изолят из вагинальных выделений коровы; 7 - изолят из органов абортплода; 8 - штамм «Оренбург». При гидролизе эндонуклеазой HpaI штаммы ТК и ТК-А не имели сайтов рестрикции, а для штамма Оренбург были получены 2 полосы, которые соответствовали размеру 254 и 210 н.п. (рисунок 2).
Рис. 2. ПДРФ-анализ изолятов BHV-1 при помощи эндонуклеазы HpaI: 1 - маркер молекулярного веса (MspI, гидролизат плазмиды pUC19); 2 - штамм «ТК-А»; 3 - штамм «ТК»; 4 - изолят из маточных выделений коровы; 5 - изолят из вагинальных выделений коровы; 6 - изолят из вагинальных выделений коровы; 7 - изолят из органов абортплода; 8 - штамм «Оренбург». Результаты типирования показали, что большая часть изолятов вируса, выявленных у животных с наличием репродуктивной патологии, относилась к респираторному субтипу вируса 1.1., что подтверждает существующее мнение о том, что аборты вызывают респираторные штаммы вируса (Cooper-подобные).
По результатам ПЦР-ПДРФ анализа 60% исследованных изоля-тов вируса были отнесены нами к субтипу 1.1. (Cooper-подобные), что соответствует рестрикционному профилю «респираторных» штаммов, 33% - к субтипу 1.2. (ТК- подобные), выделяющие чаще при генитальной форме болезни. 4% изолятов отнесены к группе «ТК-А-подобных», имеющих вакцинную природу. 3% изолятов имели «смешанный» рестрикционный профиль (Cooper- и ТК-А-подобные), что говорит о совместной циркуляции вакцинного штамма и полевых изолятов вируса ИРТ крупного рогатого скота.
В наших исследованиях мы не выявили разницы в частоте выявления вируса от инфицированных животных импортной или отечественной селекции. По нашему мнению, на частоту выявления вируса оказывают влияние концентрация животных, перегруппировки и высокая молочная продуктивность, способствующая нарушению обмена веществ и возникновению иммунодефицитных состояний.
Полученные результаты показали также, что на молочных комплексах преобладают «респираторные» штаммы вируса, вызывающие аборты у взрослых животных и респираторный синдром у молодняка. Генитальные штаммы выявляются значительно реже.
В связи с этим для установления роли возбудителя в патологии воспроизводства на молочных комплексах необходимо проводить диагностические (серологические и молекулярные) исследования. Наличие циркуляции вируса среди восприимчивого поголовья необходимо учитывать при планировании профилактических мероприятий.
Выводы:
1. Инфекционный ринотрахеит крупного рогатого скота широко распространен во всех обследованных молочных хозяйствах Сибири. Серопозитивность крупного рогатого скота различных половозрастных групп в среднем составила 72,0%. Из них, в мелких хозяйствах ее
показатели были равны 64,2%, в средних - 68%, в крупных - 86,1%. Болезнь чаще протекала субклинически, признаки «классического» вульвовагинита у коров регистрировали редко.
2. Геном вируса выявляли в пробах биологического материала от животных из хозяйств, неблагополучных по гинекологической патологии, в среднем в 23,9% от числа исследованных. Геном вируса присутствовал во внутренних органах 26,9% абортплодов 6-8-и месячного возраста и 34% мертворожденных телят. В большинстве случаев у матерей выявляли сероконверсию к вирусу после аборта. Вирус выявили в 22,4% проб вагинальных и маточных выделений и 36,4% проб плаценты первотелок и коров. Полученные данные свидетельствуют об участии вируса в патологии воспроизводства крупного рогатого скота в молочных хозяйствах.
3. По данным рестрикционного анализа, среди животных обследованных хозяйств преимущественно циркулируют штаммы «респираторного» субтипа, выявление которых было равно 60%, что подтверждает их роль в возникновении абортов. Штаммы «генитального» профиля встречаются реже (33%). Рестрикционный профиль аттенуированного вакцинного штамма «ТК-А» имели только 4% изолятов, а 3% имели «смешанный» рестрикционный профиль, что свидетельствует о совместной циркуляции вакцинного штамма и полевых изолятов у животных.
Список литературы:
Резюме. Представлены данные по изучению серологического статуса животных к вирусу инфекционного ринотрахеита крупного рогатого скота и частоты выявления генома вируса методом ПЦР-ПДРФ-анализа. Установлено широкое распространение ИРТ крупного рогатого скота в молочных хозяйствах Сибири. Серопозитивность коров и нетелей к вирусу ИРТ крупного рогатого скота составила в среднем по хозяйствам 72,0%. В мелких хозяйствах серопозитивность составила 64,2%, в средних - 68%, в крупных - 86,1%. Геном вируса выявляли в пробах биологического материала от животных из хозяйств, неблагополучных по гинекологической патологии, в среднем в 23,9% от числа исследованных. Геном вируса присутствовал в органах 26,9% абортированных плодов 6-8 месячного возраста, 34% мертворожденных телят, 22,4% проб вагинальных и маточных выделений, 36,4% проб плаценты первотелок и коров. В большинстве случаев у матерей выявляли сероконверсию к вирусу после аборта. По результатам ПЦР-ПДРФ-анализа 60% изолятов вируса отнесены к к субтипу 1.1. (Cooper-подобные), что соответствует рестрикционному профилю «респираторных» штаммов; 33% - к субтипу 1.2. (ТК-подобные), выделяющие чаще при генитальной форме болезни; 4% - к группе «ТК-А-подобных», имеющих вакцинную природу; 3% изолятов имели «смешанный» рестрикционный профиль (Cooper- и ТК-А-подобные), что свидетельствует о совместной циркуляции вакцинного штамма и полевых изолятов вируса ИРТ крупного рогатого скота. Наличие циркуляции вируса среди восприимчивого поголовья необходимо учитывать при планировании профилактических мероприя-тий.
Ключевые слова: инфекционный ринотрахеит, вирус, крупный рогатый скот, коровы, патология репродуктивной системы, серологические исследования, полимеразная цепная реакция, ПЦР-ПДРФ-анализ.
Сведения об авторах:
Котенева Светлана Владимировна, кандидат ветеринарных наук, старший научный сотрудник лаборатории биотехнологии диагностического центра ФГБУН Сибирский федеральный научный центр агробиотехнологий Российской академии наук (СФНЦА РАН); 630501, Новосибирская область, пос. Крас-нообск, а/я 463; тел.: 8-383-3087745; e-mail: koteneva-sv@mail.ru.
Семенова Ольга Владимировна, кандидат биологических наук, старший научный сотрудник лаборатории вирусологии ФГБУН Сибирский федеральный научный центр агробиотехнологий Российской академии наук (СФНЦА РАН); 630501, Новосибирская область, пос. Краснообск, а/я 463; тел.: 8-383-3087745; e-mail: k-olga-83@mail.ru. Глотова Татьяна Ивановна, доктор биологических наук, профессор, заведующая лабораторией вирусологии ФГБУН Сибирский федеральный научный центр агробиотехнологий Российской академии наук (СФНЦА РАН); 630501, Новосибирская область, пос. Краснообск, а/я 463; тел.: 8-383-308-77-45; e-mail: t-glotova@mail.ru.
Кощаев Андрей Георгиевич, доктор биологических наук, профессор, проректор по научной работе ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-861-2215637; e-mail: koshhaev.a@kubsau.ru.
Родин Игорь Алексеевич, доктор ветеринарных наук, профессор кафедры анатомии, ветеринарного акушерства и хирургии ФГБОУ ВО «Кубанский государственный аграрный университет имени И.Т. Трубилина»; 350044, г. Краснодар, ул. Калинина, 13; тел.: 8-861-2215942; e-mail: d22003807@mail.ru.
Ответственный за переписку с редакцией: Глотов Александр Гаврилович, доктор ветеринарных наук, профессор, заведующий лабораторией биотехнологии диагностического центра ФГБУН Сибирский федеральный научный центр агробиотехнологий Российской академии наук (СФНЦА РАН); 630501, Новосибирская область, пос. Краснообск, а/я 463; тел.: 8-383-3087745; e-mail: glotov_vet@mail.ru.
|
||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|