|
||||

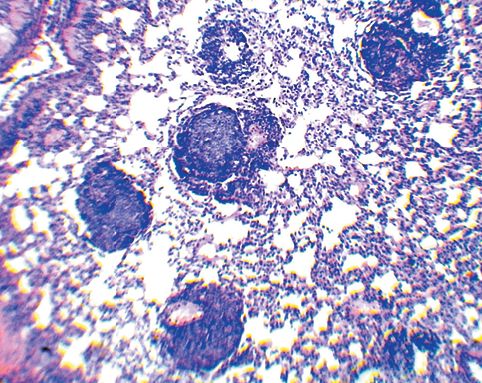
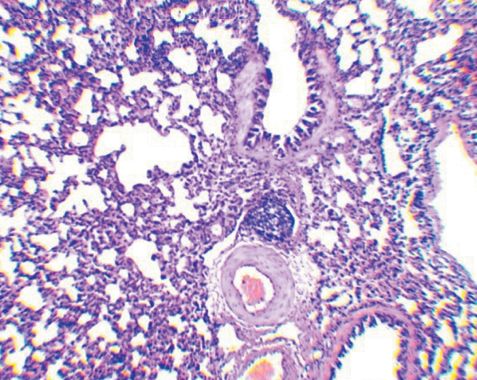
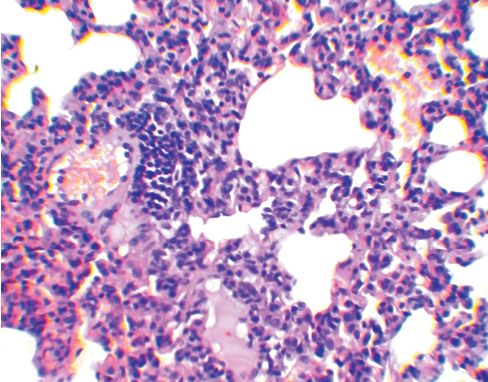
Морфология лимфоидной ткани в легких морских свинок, зараженных M. bovis, после введения антигенного комплекса БЦЖ с бетулоновой кислотойУДК 619:612.423:579.873:636.91 Оригинальное эмпирическое исследование Кошкин И. Н., Власенко В. С. Федеральное государственное бюджетное научное учреждение Аннотация. Авторами проведен анализ морфологических изменений лимфоидной ткани, ассоциированной с бронхами у морских свинок, иммунизированных антигенным комплексом БЦЖ с бетулоновой кислотой (АГ БЦЖ+БК) до экспериментального заражения вирулентной культурой микобактерий. Опыт проводили на 15 морских свинках, которых разделили на три группы по 5 особей в каждой: группа № 1 (контроль) - животным был введен подкожно физиологический раствор в объеме 0,5 мл; группа № 2 - введен АГ БЦЖ+БК тем же способом из расчета 0,5 мг/мл белка; группа № 3 - внутрикожно введена вакцина БЦЖ из расчета 0,1 мг в 0,1 мл физиологического раствора. Через 30 суток животных всех групп подкожно инфицировали вирулентной культурой M. bovis (шт. 14) в дозе 0,001 мг/мл и еще через 45 суток подвергли эвтаназии эфирным наркозом с отбором кусочков легких с участков без видимых специфических изменений для проведения гистологических исследований. Анализ морфологический изменений в легких показал, что введение экспериментального конъюгата индуцирует существенное снижение реакции бронхоассоциированной лимфоидной ткани, характеризующееся уменьшением среднего диаметра, радиуса, площади лимфатических фолликулов и их активности, а также наблюдаемым визуально увеличением числа иммунокомпетентных клеток лимфоидного ряда, продуцирующих антитела, что свидетельствует о стимуляции гуморального звена иммунитета. Ключевые слова: морские свинки, легкие, морфология, морфометрия, лимфоидный фолликул, туберкулез, конъюгат, БЦЖ, бетулоно-вая кислота, бронхоассоциированная лимфоидная ткань Лимфоидная ткань, ассоциированная с бронхами (Bronchus-associated lymphoid tissue - BALT), играет решающую роль в поддержании иммунного гомеостаза слизистой оболочки нижних дыхательных путей, постоянно подвергающихся воздействию вдыхаемых антигенов и патогенов. Согласно современным представлениям BALT, по сравнению с лимфоидной тканью слизистой оболочки кишечника, имеет множество общих особенностей развития, строения и функционирования, но в то же время существует отличие в том, что она возникает после рождения в результате стимуляции антигенами, получив название индуцированной BALT (inducible bronchus associated lymphoid tissue - iBALT) [1, 2]. Бронхоассоциированная лимфоидная ткань имеет отличия у разных видов животных. Например, BALT регулярно обнаруживается у всех здоровых кроликов и крыс (100%) и у некоторых свиней (30-50%), не встречается у мышей и человека [3], но индуцируется в легких в ответ на воздействие антигенов [4]. Уникальность iBALT состоит в том, что эта лимфоидная структура локализуется вблизи крупных бронхов, но при воспалении или инфекции может также присутствовать в периваскулярных или интерстициальных областях легкого [5]. В некоторых случаях, например при инфицировании патоген ными микобактериями, образование структуры iBALT свидетельствует об эффективном защитном иммунном ответе [4, 6]. Помимо этого, активная стимуляция ассоциированной с бронхами лимфоидной ткани происходит даже при введении морским свинкам малых доз вакцины БЦЖ [7]. По-видимому, схожий эффект будет также наблюдаться при инокуляции препаратов, полученных из вакцинного штамма БЦЖ. В предыдущие годы нами были изготовлены экспериментальные конъюгаты антигенов БЦЖ с бетулином и его производными, при этом на основании оценки эффективности иммунных реакций и патологоанатомических исследований было показано, что наиболее высокую противотуберкулезную устойчивость продемонстрировал препарат с бетулоновой кислотой [8, 9]. Исходя из этого, целью нашего исследования являлся анализ морфологических изменений лимфоидной ткани, ассоциированной с бронхами, у морских свинок, иммунизированных антигенным комплексом БЦЖ с бетулоновой кислотой до экспериментального заражения вирулентной культурой микобактерий. Материалы и методы исследования. Получение экспериментального конъюгата осуществляли путем наращивания бактериальной массы (культуры вакцинного штамма БЦЖ) на жидкой синтетической среде, последующего ее разрушения с помощью ультразвука, центрифугирования полученного дезинтеграта на высокоскоростной центрифуге и определения количества белка в надосадочной жидкости. Содержание белка доводили до 1000 мкг/мл, после чего в антигенный комплекс вносили из расчета 500 мкг/мл бетулоновую кислоту, размешивая до полного ее растворения. Опыт проводили на 15 морских свинках, которые были разделены на три группы по 5 особей в каждой: группа № 1 (контроль) животным был введен подкожно физиологический раствор в объеме 0,5 мл; группа № 2 - антигенный комплекс БЦЖ с бетулоно-вой кислотой (АГ БЦЖ+БК) тем же способом из расчета 0,5 мг/мл белка; группа № 3 - внутрикожно вакцину БЦЖ из расчета 0,1 мг в 0,1 мл физиологического раствора. Через 30 суток животных всех групп подкожно инфицировали вирулентной культурой M. bovis (шт. 14) в дозе 0,001 мг/мл и еще через 45 суток подвергли эвтаназии эфирным наркозом. Гистологические препараты готовили по стандартной методике с отбором кусочков легких с участков без видимых специфических изменений. Окраска гематоксилином и эозином. Морфометрические исследования, включающие расчет диаметра (D), радиуса (R) и площади (S) лимфатических фолликулов BALT, осуществляли с помощью бинокулярного микроскопа марки Zeizz AXIO Imager A1, цифровой камеры и программы ScopePhoto. В работе использовали окуляр со встроенной в него специальной сеткой. Статистическая обработка осуществлялась на ПК с использованием программы Excel из пакета Microsoft Office. Результаты исследований и их обсуждение. Почти вокруг всех кровеносных сосудов паренхимы легких морских свинок контрольной группы наблюдается скопление лимфоидных клеток. В большинстве сосудов лимфоидные скопления полностью их окружают, формируя так называемые муфты. Ширина клеточных муфт по окружности сосуда и их длина разные. Разрастание лимфоидной ткани в муфтах иногда происходит эксцентрично с образованием типичного фолликула. В большинстве формирующихся фолликулов появляются центры размножения (герминативные центры) (рисунок 1). В некоторых фолликулах происходит размножение ретикулоцитов и макрофагов, то есть образуются реактивные центры. На срезах просматривается связь подавляющей части лимфатических фолликулов с кровеносными сосудами. Лимфоидная ткань около бронхов скапливается в меньшей степени, чем вокруг сосудов.
Рис. 1. Легкое морской свинки (группа № 1, контроль) - лимфатические фолликулы с выраженным центром размножения; в нижнем фолликуле отмечается связь с кровеносным сосудом (окраска гематоксилином и эозином, ув. х50) В легких морских свинок, иммунизированных АГ БЦЖ+БК (2-я группа), среди размножающихся в межальвеолярной ткани клеток обнаруживается большое количество плазмоцитов. Пролиферация лимфоидных клеток вокруг кровеносных сосудов и бронхов с образованием клеточных муфт у морских свинок 2-й группы выражена значительно меньше по сравнению с конт рольной группой. Возле стенок бронхов разного калибра скопление лимфоидных клеток либо отсутствует, либо оно незначительно. Вокруг большинства кровеносных сосудов также отсутствуют муфты из лимфоидных клеток, а если они есть, то также имеют небольшую ширину. Формирования фолликулов в периваскулярных муфтах не выявлено. Количество лимфатических фолликулов в легких морских свинок, сенсибилизированных АГ БЦЖ+БК визуально меньше относительно группы №1 (рисунок 2). В фолликулах не выражена зона размножения (рисунок 3).
Рис. 2. Легкое морской свинки (группа № 2) - участки уплотнения разного размера в ткани легкого; лимфатический фолликул около бронха и кровеносного сосуда (окраска гематоксилином и эозином, ув. х50)
Рис. 3. Легкое морской свинки (группа № 2) - лимфатический фолликул без зоны размножения, формирующийся около сосуда (окраска гематоксилином и эозином, ув. Х100) У особей, вакцинированных БЦЖ, по сравнению группой № 1 (контроль) размножение эпителиоидных макрофагов в межальвеолярной ткани, а также скопление лимфоидной ткани возле бронхов, сосудов и в форме фолликулов в значительно меньшей степени выражено. Лимфоидные клетки образуют вдоль бронхов небольшого размера скопления. Периваскулярные муфты из лимфоидных клеток имеют небольшую ширину и протяженность, в них не наблюдается выраженный процесс формирования лимфатических фолликулов, но в сформировавшихся фолликулах сохраняется связь с кровеносными сосудами. В лимфатических фолликулах, в отличие от контрольной группы генеративные и реактивные центры не выражены. Меньший размер лимфатических фолликулов у морских свинок 2-й и 3-й опытной группе также подтверждается морфометрическими исследованиями, результаты которых представлены в таблице 1. Таблица 1 Морфометрические показатели лимфатических фолликулов BALT у морских свинок, инфицированных M. bovis, после введения противотуберкулезных препаратов, M±m
Примечание: * - p<0,01; ** - p<0,001 Морфометрические исследования показали, что лимфатические фолликулы инфицированных морских свинок контрольной группы имеют диаметр 203,0±8,8 мкм, радиус 101,5±4,4 мкм и площадь 34103,0±2766,5 мкм2 (табл. 1). При инокуляции экспериментального конъюгата средний диаметр, радиус и площадь фолликулов в легких составили соответственно 115,7±6,5 мкм, 57,8±3,2 мкм и 11458,4±1240,7 мкм2 и были по сравнению с морскими свинками контрольной группы значительно меньшими, о чем свидетельствовало достоверное снижение указанных показателей в 1,75-2,97 раза. У морских свинок, иммунизированных вакциной БЦЖ, также в значительной степени отличались от контрольной группы, на что указывало достоверное уменьшение анализируемых морфометрических параметров в 1,31 - 1,64 раза. Эти показатели были выше, чем в группе особей, подвергнутых обработке экспериментальным конъюгатом. При гистологическом исследовании легких морских свинок, инфицированных вирулентным штаммом микобактерий, установлено, что формирующийся иммунный ответ на генерализацию возбудителя сопровождается размножением лимфоидных клеток вокруг кровеносных сосудов и бронхов разного калибра и образованием типичных лимфатических фолликулов. Преимущественное обнаружение лимфоидной ткани в виде клеточных муфт различной ширины и длины вокруг кровеносных сосудов указывает на гематогенную диссеминацию возбудителя. Разрастаясь эксцентрично, лимфоидные муфты, локализующиеся вокруг кровеносных сосудов, формируют множество фолликулов с центрами размножения и реактивными центрами, которые, по нашему мнению, относятся к iBALT, являющейся свидетельством антигенной стимуляции, вызванной наличием в крови возбудителя. Ряд исследователей отмечает, что фолликулы в реактивных областях iBALT могут содержать крупные зародышевые центры, в которых В-клетки быстро размножаются в ответ на воздействие антигена [5]. Т-клеточная зона iBALT, содержащая Т-хелперы, Т-супрессоры и обычные дендритные клетки, окружает В-клеточные фолликулы [10]. Отсутствие туберкул с активным процессом в легких зараженных морских свинок может быть результатом действия iBALT. Так, T. Ulrichs et al. [11] в своем исследовании указывает, что развитие таких лимфоидных скоплений в легких было связано с контролируемым туберкулезным процессом, тогда как отсутствие или дезорганизация iBALT - с неконтролируемой инфекцией M. tuberculosis. После применения противотуберкулезных препаратов обнаруживалось существенно меньшее, чем у не иммунизированных морских свинок, количество лимфоидной ткани вокруг сосудов и бронхов. Значительно меньшим был и диаметр фолликулов, в которых не были явно выражены центры размножения, а реактивных центров выявлено не было. Связано это, по нашему мнению, с уменьшением концентрации антигена в крови в результате выработки иммунитета. В ряде работ также указывается на выработку при вакцинации БЦЖ иммунитета в легких, приводящего к уменьшению роста микобактерий [12]. Заключение. На основании проведенных исследований можно прийти к заключению о том, что инокуляция экспериментального конъюгата индуцирует существенное снижение реакции бронхоассоциированной лимфоидной ткани, которое выражается в уменьшении среднего диаметра, радиуса и площади лимфатических фолликулов и их активности. Вместе с тем, в ткани легких морских свинок, подвергнутых обработке экспериментальным конъюгатом, визуально регистрировалось большее количество плазматических клеток, что может указывать на стимуляцию гуморального звена иммунитета, индуцированную действием этого препарата. Список литературы: 1. He W., Zhang W., Cheng C., Li J., Wu X., Li M., Chen Z., Wang W. The distributive and structural characteristics of bronchus-associated lymphoid tissue (BALT) in Bactrian camels (Camelus bactrianus). PeerJ. 2019. Vol. 7. e6571. 2. Silva-Sanchez A., Randall T.D. Anatomical Uniqueness of the Mucosal Immune System (GALT, NALT, iBALT) for the Induction and Regulation of Mucosal Immunity and Tolerance. Mucosal Vaccines. 2020. P. 21-54. 3. Seefeld M.L., Templeton E.L., Lehtinen J.M., Sinclair N., Yadav D., Hartwell B.L. Harnessing the potential of the NALT and BALT as targets for immunomodulation using engineering strategies to enhance mucosal uptake. Front. Immunol. 2024. Vol.15. P. 1419527. 4. Marin N.D., Dunlap M.D., Kaushal D., Khader S.A. Friend or Foe: The Protective and Pathological Roles of Inducible Bronchus-Associated Lymphoid Tissue in Pulmonary Diseases // J Immunol. 2019. Vol. 202(9): 2519-2526. doi: 10.4049/jimmunol.1801135 5. Hwang J.Y., Randall T.D., Silva-Sanchez A. Inducible Bronchus-Associated Lymphoid Tissue: Taming Inflammation in the Lung. Front Immunol. 2016. Vol. 7: 258. 6. Dunlap M.D., Prince O.A., Rangel-Moreno J., Thomas K.A., Scordo J.M., Torrelles J.B., Cox J., Steyn A.J.C., Zuniga J., Kaushal D., Khader S.A. Formation of Lung Inducible Bronchus Associated Lymphoid Tissue Is Regulated by Mycobacterium tuberculosis Expressed Determinants. Front Immunol. 2020. Vol. 11. P. 1325. 7. Bachvarova M., Stefanova T., Nikolaeva S., Chouchkova M. Tuberculin sensitivity and morphological immune response in guinea pigs after application of minimal sensitizing dose of BCG vaccine, substrain Sofia SL222. Int Immunopharmacol. 2009. 9 (7-8). P. 1010-1015. 8. Кошкин И.Н., Власенко В.С., Бажин М.А. Функциональная активность нейтрофилов у морских свинок, иммунизированных конъюгатами на основе антигенов БЦЖ с бетулином и его производными. Вестник КрасГАУ. 2021. 5. P. 116-121. 9. Koshkin I.N., Vlasenko V.S., Kulakov I.V. The Effect of Experimental BCG Antigen-Betulin-Derived Conjugates on the Guinea Pig Immunological Response. Russ J Bioorg Chem. 2021. Vol. 47. P. 837-844. 10. Vinuesa C.G., Linterman M.A., Yu D., MacLennan I.C. Follicular helper T cells. Annu Rev Immunol. 2016. Vol. 34. P. 335-368. 11. Ulrichs T., Kosmiadi G.A., Jorg S., Pradl L., Titukhina M., Mishenko V., Gushina N., Kaufmann S.H. Differential organization of the local immune response in patients with active cavitary tuberculosis or with nonprogressive tuberculoma. J Infect Dis. 2005. Vol. 192(1). P. 89-97. 12. Ordway D., Henao-Tamayo M., Shanley C., Smith E.E., Palanisamy G. Influence of Mycobacterium bovis BCG Vaccination on Cellular Immune Response of Guinea Pigs Challenged with Mycobacterium tuberculosis. Clin Vaccine Immunol. 2008. Vol. 15 (8). P. 1248-1258. Сведения об авторах: Кошкин Иван Николаевич, кандидат ветеринарных наук, старший научный сотрудник лаборатории эпизоотологии и мер борьбы с туберкулезом ФГБНУ «Омский аграрный научный центр»; 644001 Омская область, г. Омск, ул. Лермонтова, д. 93; тел.: 8-929-3656869; e-mail: koshkin@anc55.ru. Ответственный за переписку с редакцией: Власенко Василий Сергеевич, доктор биологических наук, профессор, главный научный сотрудник лаборатории эпизоотологии и мер борьбы с туберкулезом ФГБНУ «Омский аграрный научный центр»; 644001 Омская область, г. Омск, ул. Лермонтова, д. 93; тел.: 8-951-4083421; e-mail: vvs-76@list.ru. Заявленный вклад авторов: Кошкин И. Н.: формальный анализ, проведение исследования, визуализация, написание черновика рукописи. Власенко В. С.: разработка концепции, административное руководство исследовательским проектом, валидация результатов, написание рукописи - рецензирование и редактирование. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|