|
||||

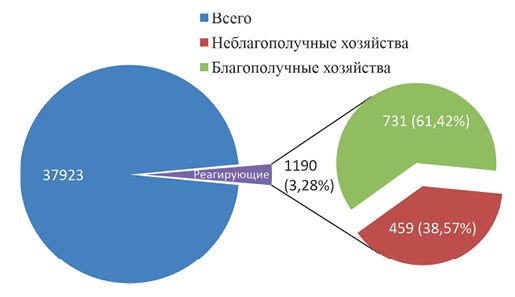
К совершенствованию дифференциальной диагностики туберкулеза крупного рогатого скота в условиях ДагестанаУДК 619:616.98:579.873.21Т-07 Оригинальное эмпирическое исследование Баратов М. О. Прикаспийский зональный научноисследовательский ветеринарный институт - филиал Федерального Аннотация. Неспецифические реакции - одна из актуальных проблем в диагностике туберкулеза животных. Проведены исследования по оценке некоторых методов дифференциальной диагностики, отражены результаты изучения эпизоотической ситуации в хозяйствах разной категории во всех природно-климатических зонах Республики Дагестан. Исследовано 37 923 головы крупного рогатого скота, экспериментальному заражению подвергнуто 35 морских свинок, внутривенная проба изучена на 138 животных. При оценке результатов аллергических исследований установлены существенные различия в количестве реагирующих на туберкулин животных: в благополучных хозяйствах - 61,42%, по сравнению с неблагополучными - 38,57%. Выявлено наличие неспецифической сенсибилизации животных во всех поясах вертикальной зональности. Отмечено, что в связи с отсутствием статистических данных невозможно провести эпизоотический анализ в целом по республике. Неспецифический характер реакции на туберкулин подтвержден патологоанатомическим и лабораторными методами. Изучены сенсибилизирующие к туберкулину свойства изолированных культур M. scrofulaceum, M. qordonae, M. avium-intracellulare, M. smegmatis, M. fortuitum. Все зараженные морские свинки, за некоторым исключением, реагировали на КАМ со средней интенсивностью 16,3±0,8. В неблагополучных хозяйствах пальпебральная и внутривенная пробы показывают диагностическую значимость, что подтверждается другими методами исследования. Отмечена специфичность пальпебральной пробы и в благополучных хозяйствах. Результаты исследования внутривенной пробой здоровых животных, реагирующих на туберкулин с интенсивностью 3,5±0,13 мм, показали низкую диагностическую значимость. Температура не поднималась выше 0,6°С, не выявлено клинических изменений. Полученные данные расширяют представления о значимости предложенных методов дифференциальной диагностики туберкулеза. Ключевые слова: туберкулез, неспецифические реакции, парааллергические реакции, псевдоаллергические реакции, туберкулин, диагностика, сенсибилизация, коровы, морские свинки, пальпебральная проба, внутривенная проба. В диагностике туберкулеза животных неспецифические реакции к туберкулину остаются важной проблемой. Несмотря на многочисленные работы по характеристике классификаций данных реакций, многие аспекты этой проблемы требуют дополнительного изучения. До настоящего времени специалисты придерживались точки зрения, в основу которой заложен принцип гомо- или гетерологичности аллергена к объекту сенсибилизации, сформулированной при изучении фенотипических характеристик возбудителей, согласно которому, аллергические реакции делятся на специфические и неспецифические [1, 10]. Наиболее изученные реакции - парааллергические (сенсибилизация, вызванная микобактериями птичьего вида, нетуберкулезными и сапрофитными микобактериями, а также микобактериоподобными микроорганизмами); и менее изученные - псевдоаллергические, обусловленные различными этиологическими причинами немикобактериального характера [12, 14]. В печати имеются сообщения о несостоятельности использования термина «псевдоаллергические», согласно которым проявление реакций на любой гетерологичный аллерген считается парааллергическим. Любая причина немикобактериального происхождения, сенсибилизирующая организм животных к ППД-ту-беркулину, представляется гетерологичной аллергену, следовательно, причина - парааллергическая [6]. Донченко А. С. (2004), Найманов А. Х. (2006), с соавторами обращают внимание на противоречивый характер многочисленных литературных данных о природе аллергических реакций и значительные трудности в их классификации [3, 4]. Важно отметить, что клиническая картина сенсибилизации организма (увеличение кожной складки) во всех случаях схожая, что, безусловно, вносит определенную неразбериху в прижизненную диагностику и выводит на первый план лабораторный и патологоанатомический методы. Присутствие множественности понятий в силу неизученности характера реакции, бесспорно, наносит большой экономический ущерб животноводству. Ветеринарным специалистам приходится подтверждать результаты предыдущих методов исследования результатами последующих, зачастую при этом растягивая дифференциацию на 5-6 месяцев [5, 8, 9, 13]. Установлены многочисленные подтвержденные данные, указывающие на широкое и повсеместное распространение разного рода аллергических реакций на ППД-туберкулин во многих регионах России и странах ближнего зарубежья. В то же время, имеющиеся незначительные малоинформативные данные о сенсибилизации животных к туберкулину во всех категориях хозяйств в условиях Республики Дагестан не позволяют сформулировать эпизоотическую характеристику ситуации по туберкулезу [2, 5, 7, 11]. В связи с чем, целью настоящего исследования явилось выявление реагирующих на туберкулин животных в хозяйствах различных категорий, определение причин их сенсибилизации и изыскание методов дифференциальной диагностики. Материалы и методы исследований. В целях установления степени распространения аллергических реакций на туберкулин для млекопитающих проводились исследования внутрикожной пробой животных (коровы, нетели, телки) в благополучных и неблагополучных по туберкулезу хозяйствах. Всего было исследовано 37 923 головы крупного рогатого скота. Для заражения 35 морских свинок использовались местные эпизоотические штаммы M. scrofulaceum, M. qordonae, M. avium-intracellulare, M. smegmatis, M. fortuitum. Аллергические исследования проводились введением ППД-туберкулина для млекопитающих и КАМ в соответствии с «Наставлением по применению туберкулинов для млекопитающих и птиц (2002)» и «Наставлением по проведению симультанной пробы с КАМ (1992)». Туберкулин вводился внутрикожно в дозе 0,2 мл с помощью безыгольного инъектора. Внутривенному исследованию подвергнуто 138 голов, при котором туберкулин вводился в ярёмную вену в дозе 1 мл на 100 кг. Результаты учитывались через каждые 3 часа в течение 12 часов. Повышение температуры на 1 и более градус считалось положительной реакцией. Убой реагирующих животных проводился комиссионно, для лабораторного исследования отбирались лимфатические узлы и кусочки паренхиматозных органов. Посевы проводились на питательные среды ФИНН-2, Сотона и Левенштейна-Йенсена. Для изучения сенсибилизирующих свойств выделенными культурами заражали морских свинок. Результаты исследований и их обсуждение. Всего на протяжении 5 лет (2019-2023 гг.) в хозяйствах, благополучных по туберкулезу (СПК «Лаказан», КФЗ «Рамазан» (горная зона), СПК «Кадар», СПК «Первомайское» (предгорная зона), СПК «Сулак», КФХ «Сангар» (равнинная зона)), обследовано 20960 животных; неблагополучных - горная зона (СПК «Дултыдаг», СПК «Каспий»), предгорная зона - (СПК «Каскад», КФХ «Казбек»), равнинная зона - (КФХ «Дагестан», СПК «Тисса»), обследовано 6963 головы (рисунок 1).
Рис. 1. Частота проявления реакций на туберкулин в стадах различной категории хозяйств Республики Дагестан По результатам исследования 61,42% реагирующих на туберкулин животных приходится на благополучные хозяйства, независимо от их географической расположенности (горная, предгорная, равнинная). Следует отметить, что статистические данные ветеринарного Комитета Республики показывают количество реагирующих на туберкулин животных в неблагополучных хозяйствах. Так, за последние 10 лет выявлено 4 957 (0,07%) реагирующих из 7 673,5 тыс. исследованных. В то же время число реагирующих на туберкулин животных в благополучных хозяйствах в целом по республике остаётся неизвестным, несмотря на многочисленные сообщения о наличии положительной динамики в их выявлении. В благополучных хозяйствах из числа реагирующих на туберкулин животных по 3 коровы подвергли диагностическому убою. При этом характерные для туберкулеза изменения не были обнаружены. В целях выяснения причин аллергических реакций материал от убойных животных подвергался лабораторному исследованию. По результатам исследований ни в одном из случаев возбудитель туберкулеза не был обнаружен. Во всех случаях изолировали атипичные микобактерии, наиболее часто - представители II, III и IV групп Раньона (M. scrofulaceum, M. qordonae, M. avium-intracellulare, M. smegmatis, M. fortuitum). Сенсибилизирующую способность выделенных культур удалось определить в опыте на морских свинках с отрицательными реакциями на туберкулин. Подкожному заражению по 2 мг влажной бакмассы, суспензированной в 1 мл физраствора, было подвергнуто 35 морских свинок (по 7 голов на культуру). Через 25 дней животных исследовали симультанно, ППД-туберкулином в дозе 40 МЕ в 0,1 мл с одной стороны, и КАМ в дозе 10 МЕ - с другой. Через 48 часов все опытные животные, кроме зараженных M. fortuitum, реагировали на КАМ со средней интенсивностью 16,3±0,8. У реагирующих непигментированных свинок отмечалось покраснение кожи на участке в 6-10 мм в диаметре. На ППД-тубер-кулин для млекопитающих свинки не реагировали. Ранее нами установлена дифференцирующая неспецифические реакции способность пальпебральной и внутривенной проб в неблагополучных по туберкулезу хозяйствах. Установлено, что у животных, реагирующих на пальпебральную и внутривенную пробы, практически во всех случаях патологоанатомическим и лабораторным методами подтверждался туберкулез. Данные свидетельствуют о том, что результаты могут являться определяющим фактором при выборе животных для патологоанатомического убоя. Вместе с тем, специфичность пальпебральной пробы в дифференциации неспецифических реакций была изучена и в благополучных хозяйствах, о чем свидетельствуют многочисленные данные отечественных и зарубежных исследователей. В то же время, незначительное количество разрозненных данных о специфичности внутривенной пробы у здоровых животных указывает на необходимость ее изучения в данной категории хозяйств. По данным ряда исследователей, трудоемкость выполнения на большом количестве животных и невозможность повторного исследования даже внутрикожной пробой в течение длительного периода, в связи с десенсибилизацией организма, являются сдерживающим фактором применения этой пробы в производственных условиях с учетом изменившихся условий хозяйствования, в связи с его реформированием, образованием огромного количества мелких фермерских, крестьянских и индивидуальных хозяйств с ограниченным количеством животных [3, 4, 6]. Однако нам применение этой пробы представляется возможным в качестве дифференцирующего теста. Объектом исследования служили реагирующие на туберкулин коровы и нетели в благополучном по туберкулезу хозяйстве, средняя интенсивность реакции на ППД-туберкулин во внутрикожной пробе которых составила 3,5±0,13 мм (табл. 1). Таблица 1 Испытания внутривенной пробы на животных с неспецифическими реакциями на ППД-туберкулин для млекопитающих
По результатам ни одно животное не реагировало на испытываемую пробу. Температура тела поднималась после введения туберкулина в среднем на 0,1-0,6°С выше среднесуточной. Изменений в клиническом состоянии животных не наблюдали. Заключение. Неспецифические реакции на туберкулин за последние несколько десятилетий получили широкое распространение. Связано это с наличием множества микроорганизмов, часто - в виде ассоциативного симбиоза, с общими группоспецифическими данными с микобактериями. По многочисленным литературным данным, основной причиной таких реакций выступают нетуберкулезные микобактерии, изолируемость которых в благополучных хозяйствах достигает 46,4%. Данные являются свидетельством потери решающего значения внутрикожной пробы, результаты которой стали учитывать как ориентировочные в хозяйствах всех форм собственности. В связи с этим, практические ветеринарные специалисты испытывают определенные трудности в постановке диагноза на туберкулез, поэтому в последнее время все чаще используют тандемные повторы различных методов исследования для выявления причин сенсибилизации из огромного пара- и псевдоразнообразия причин. По результатам комбинаторного использования пальпебральной и внутрикожной проб удается дополнительно выявить в среднем 5,6% животных, у которых в 65,9% случаев туберкулез подтверждается другими методами. Полученные данные свидетельствуют о том, что в неблагополучных по туберкулезу хозяйствах пальпебральная проба более чувствительна, нежели офтальмопроба. Следует отметить простоту постановки, учета и оценки реакции, сокращение времени, экономию средств, что делает эту пробу более приемлемой для комплексной диагностики туберкулеза у крупного рогатого скота. Данная проба позволяет дифференцировать реакции у животных и в благополучных хозяйствах. Результаты исследований показали диагностическую значимость внутривенной пробы в неблагополучных хозяйствах, по результатам которой предлагается отбирать животных для диагностического убоя. У здоровых животных температура тела не поднималась более чем на 0,6°С. Таким образом, представленные результаты испытания некоторых предложенных методов дифференциации реакций на ППД-туберкулин для млекопитающих подтвердили существующую точку зрения об отсутствии универсального метода с высокой разрешающей способностью в разных категориях хозяйств. Полученные данные расширяют представления о дифференцирующих способностях предложенных методов и могут быть использованы для совершенствования диагностики туберкулеза животных. Результаты исследования позволяют предложить в качестве дополнительного теста в неблагополучных хозяйствах с внутрикожной пробой пальпебральную вместо офтальмопробы. Положительная реакция такой пробы может служить основанием для отбора животных для диагностического убоя. Список литературы: 1. Баратов М. О., Семененко М. П. Нетуберкулезные микобактерии: сенсибилизирующая роль и патоморфологические изменения в организме зараженных животных. Ветеринария Кубани. 2024; (4): 16-21. 2. Баратов М. О., Ахмедов М. М. Влияние природно-географических условий Дагестана на интенсивность эпизоотического процесса по туберкулёзу. 2007. 3. Донченко А. С., Овдиенко Н. П., Донченко Н. А. Диагностика туберкулеза КРС. 2004: 306. 4. Найманов А. Х., Овдиенко Н. П., Помыканов Н. П. Диагностика туберкулеза крупного рогатого скота в индивидуальных хозяйствах. 2006: 297-302. 5. Нуратинов Р. А., Газимагомедов М. Г. Туберкулез. 2009: 336 с. 6. Овдиенко Н. П. Эпизоотология и диагностика туберкулеза крупного рогатого скота в условиях интенсификации животноводства. Автореф. диссерт. докт. вет. наук. 1990: 490 с. 7. Смирнов А. Н. Современные проблемы диагностики туберкулеза животных. Ветеринарная патология. 2004; (1-2 (9): 10-13. 8. Спиридонова Г. Г. Значение некоторых диагностических тестов в дифференциации туберкулиновых реакций. 1999: 273-275. 9. Прокопьева Н. И. Изучение природы аллергических реакций у крупного рогатого скота благополучных по туберкулезу стад. Ветеринарная патология. 2004; (1-2 (9): 134-136. 10. Урбан В. П., Широбокова М. М., Данко Ю. Ю. Аллергическая диагностика туберкулеза. Профилактика и ликвидация заразных болезней животных. 1985: 80-85. 11. Хазипов Н. З., Сафин М. А., Идрисов Г. З. Туберкулез крупного рогатого скота. 1985: 126 с. 12. Beerwerth W. Mikobacterium in Viehtranken und Oberflachengewasser. Dtsch. Tierazztl. Wschr. 2003; (80): 398-401. 13. Barksdale L., Kim K. S. Mycobacterium. Bacteriol Revs. 2007; (41 (2): 217-372. 14. Goren M. B. Mycobacterial lipids: selected topics. Bacteriol. Revs. 2009; (36 (1): 33-36. Сведения об авторах: Баратов Магомед Омарович, доктор ветеринарных наук, главный научный сотрудник, заведующий лабораторией инфекционной патологии Прикаспийского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный аграрный научный центр Республики Дагестан»; 367000, г. Махачкала, ул. Дахадаева, 88; тел. 8-928-5010948; e-mail: alama500@rambler.ru. Ответственный за переписку с редакцией: Семененко Марина Петровна, доктор ветеринарных наук, доцент, заведующая отделом фармакологии ФГБНУ «Краснодарский научный центр по зоотехнии и ветеринарии»; 350004, г. Краснодар, ул. 1-я Линия, 1; тел.: 8-918-4612663; e-mail: sever291@mail.ru. Заявленный вклад авторов: Баратов М.О.: разработка концепции, курирование данных, разработка методологии, административное руководство исследовательским проектом, предоставление ресурсов, научное руководство. Семененко М.П.: валидация результатов, визуализация, написание рукописи, рецензирование и редактирование. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|