|
||||

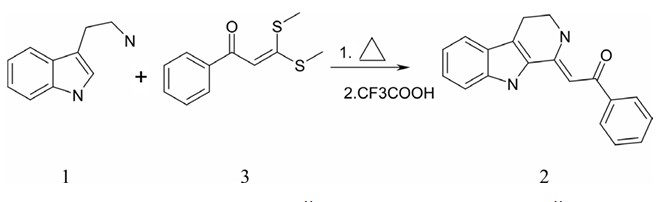
Поиск антибактериальных и антипротозойных соединений в ряду производных алкалоида бета-карболинаУДК 619: 616. 993.192 Зубенко А. А., Фетисов Л. Н., Святогорова А. Е., Авагян Э. Н. Северо-Кавказский зональный научноисследовательский Наши исследования направлены на создание противо-инфекционных средств неантибиотической природы, что особенно важно в связи с возрастающей проблемой лекарственной устойчивости микроорганизмов. Актуальным направлением поиска лекарственных средств является модификация природных соединений, обладающих известной биологической активностью. Алкалоиды и их производные обладают немалым потенциалом трансформации в биологически активные структуры [2, 3]. Значительное число современных лекарственных веществ имеют в своей основе природное происхождение. Среди природных соединений алкалоиды представляют наиболее интересный класс химических веществ. Алкалоиды ряда в-карболинов представляют собой необычное семейство природных и синтетических индолсодержащих гетероциклических соединений с различной степенью ароматичности [15]. Этот класс алкалоидов имеет плоскую трициклическую пиридоиндольную кольцевую систему и первоначально был выделен из семян Peganum harmala, дикорастущего многолетнего травянистого растения, принадлежащего к семейству Zygophillaceae. Это растение традиционно использовалось для лечения рака желудочно-кишечного тракта и малярии в Центральной Азии, на Ближнем Востоке и в Северной Африке. Почти 64 известных алкалоида в-карболина распространены по меньшей мере в восьми семействах растений. Эти алкалоиды также широко распространены в микроорганизмах [12], насекомых [8], табачном дыме [16], тканях человека, жидкостях организма, морских беспозвоночных (мшанки, гидроиды, мягкие кораллы, губки) [7, 14], морских асцидиях (род Eudistoma). Фрагмент в-карболи-на представляет собой основную структуру, присутствующую в более чем 100 алкалоидах и синтетических каркасах с широким спектром биологических свойств, таких как противовоспалительное [18], снотворное [19], противосудорожное [5], противопара-зитарное [6], противоопухолевое [17, 21], противомикробное [4] и противовирусное [20]. Разнообразие биологических активностей в последнее время сделало эти соединения предметом повышенного интереса. Важный класс гетероциклических соединений представляют собой 1,2,3,4-тетрагидро-в-карболины, широко представленный в живой природе [20], в том числе некоторыми их простейшими производными, такими, например, как 1-метил- и 6-гидрокси-1-ме-тил-1,2,3,4-тетрагидро-бета-карболины, 1,2,3,4-тетрагидро-3-кар-бокси- и 1,2,3,4-тетрагидро-3-карбокси-1-метил-в-карболины, обнаруженными в некоторых фруктах и шоколаде [9, 10, 13]. 1,2,3,4-тетрагидро-в-карболиновое ядро является частью циклического каркаса ряда алкалоидов, в частности, резерпина, аймалина, а также эвдистоминовых алкалоидов (eudistomins), обнаруженных в некоторых морских организмах [11]. Производные карболина обладают разнообразной биологической активностью, в том числе, как циклические аналоги триптамина. Цель настоящего исследования синтез и определение уровня антипротозойной и антибактериальной активности в ряду алко-лоида бета-карболина. Материалы и методы исследований. Синтез новых соединений проводили в лаборатории химического синтеза СКЗНИВИ-филиал ФГБНУ ФРАНЦ и в Научно-исследовательском институте физической и органической химии Южного федерального университета. Синтез соединений осуществляли с использованием как известных методов синтеза органических соединений, описанных в многочисленных руководствах, так и с применением разработанных нами методов, изложенных в описании к патенту РФ № 2394824 и в статьях и тезисах: Материалы Первой международной конференции «Химия и биологическая активность гетероциклов и алкалоидов» (2002 г.); Материалы международной конференции «Синтез и биологическая активность азотсодержащих гетероциклов» (2006 г.); Тезисы IV международной конференции «Новые направления в химии гетероциклов» (2010 г.). Антибактериальную активность определяли диско-диффузионным методом. Для исследований использовали мясопептонный агар, который заливали в чашки Петри по 25 мл в каждую. Чашки подсушивали в течение 10-20 минут. На поверхность чашек Петри с питательной средой наносили микропипеткой 1-2 мл взвеси стандартных штаммов Staphylococcus aureus (штамм ВКМ V-128) или Escherichia coli (штамм ВКМ V-820) густотой 5 единиц оптического бактериального стандарта мутности. Распределяли взвесь равномерно по поверхности среды, избыток удаляли. Чашки подсушивали 20-30 минут. Размечали на сектора (3-6). В сектора размещали по 1 диску из картона фильтровального НД-ПМП-1 ГОСТ 6722-75 (Пр-во ФБУН НИИ эпидемиологии и микробиологии имени Пастера, Отдел новых технологий, Санкт-Петербург). На диск наносили микропипеткой 15 микролитров суспензии испытуемого соединения на дистиллированной воде концентрацией 1000 мкг/мл, что составляет 15 мкг препарата на каждый диск. Подготовленные чашки помещали в термостат при 370C на 24 часа. Препараты сравнения - фуразолидон и ципрофлоксацин. Оценивали величину зоны задержки роста бактериальной культуры вокруг диска в мм. Методика в модификации СКЗНИВИ описана в высокорейтинговом зарубежном журнале Polyhedron. Исследование протистоцидной активности проводили по методике [1] на простейших вида Colpoda steinii (полевой изолят, коллекция лаборатории паразитологии ФГБНУ СКЗНИВИ). Работу выполняли в микропланшетах для постановки ИФА. В качестве среды для переживания простейших использовали смесь кипяченой водопроводной воды и стерильной дистиллированной воды в равных объемах. Первоначальное разведение вещества готовили на дистиллированной воде в присутствии ДМСО. Препарат сравнения - толтразурил. Результат оценивали по величине минимальной ингибирующей концентрации в мкг/мл. Разработанная нами методика опубликована в журнале Polyhedron. Результаты исследований и их обсуждение. Целью наших исследований являлся двухстадийный синтез (рисунок 1) соединений 2 из триптаминов 1 и винильных серусодержащих соединений 3 и изучение их антипротозойных и антибактериальных свойств. В работе по синтезу 2 нами использована описанная в литературе [6] методика получения соединений 2 с различными заместителями как в карболиновом, так и в арильном заместителе.
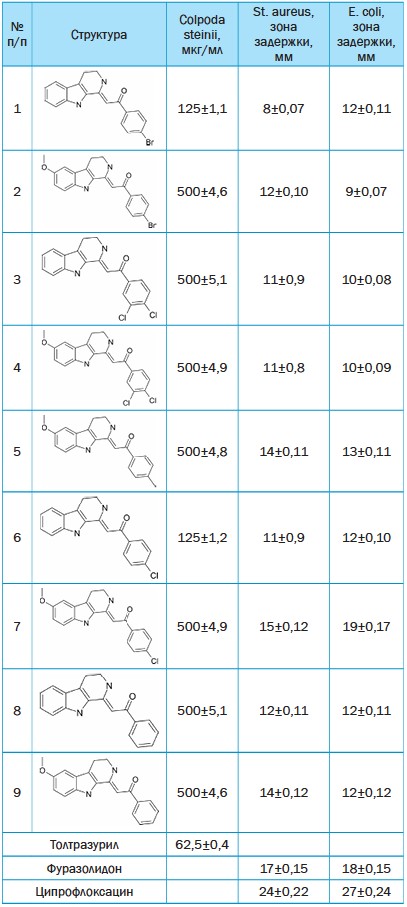
Рис. 1. Схема двухстадийного синтеза соединений (2) из триптаминов (1) и винильных серусодержащих соединений (3) В таблице 1 представлены структуры синтезированных соединений и их антипротозойная (протистоцидная) и антибактериальная активность. Таблица 1 Результаты определения антипротозойной и антибактериальной активности производных алкалоида бета-карболина
Из данных таблицы 1 видно, что все испытанные структуры обладают антипротозойной активностью, однако всего лишь два соединения (номера 1 и 6) проявляют значительную активность, хотя и в этом случае они в два раза менее активны, чем препарат сравнения толтразурил. Более значима антибактериальная активность представленных соединений. Все структуры активны как в отношении грам-положительной бактерии St.aureus, так и грамотрицательной E.coli с зонами задержки от 8 до 19 мм, причём соединение 7 практически не уступает по активности фуразолидону, что указывает на перспективность поиска противомикробных средств среди подобных производных алкалоида карболина. Относительно влияния заместителей на величину активности, можно сделать вывод, что соединения с метоксигруппой в карболиновом фрагменте (структуры 2, 4, 5, 7 и 9) заметно активнее, чем 1, 3, 6, 8. Выводы: 1. Синтезированы 9 производных алкалоида в-карболина. 2. Изучены антибактериальные и протистоцидные активность синтезированных соединений. 3. Соединения более активны в отношении бактериальной микрофлоры. Список литературы: 1. Изыскание протистоцидных средств / Л. Н. Фетисов, А. А. Зубенко, А. Н. Бодряков [и др.] / Вопросы нормативно-правового регулирования в ветеринарии. 2012. № 4/1. С. 70-72. 2. Новые структурные модификации производных алкалоида котар-нина котарнона и дигидрокотарнина / В. Г. Карцев, А. А. Зубенко, Л. Н. Диваева [и др.] // Журнал общей химии. 2020. Т. 90. № 2. С. 261-267. 3. Юнусов, С. Ю. Алкалоиды / С. Ю. Юнусов // ФАН. 1981. С. 418. 4. An overview on synthetic entries to tetrahydro-p-carbolines / P. Maity et al. // Tetrahedron. 2019. 5. Application of modified Pictet-Spengler reaction for the synthesis of thiazolo- and pyrazolo-quinolines / S. Duggineni et al. // Tetrahedron. 2006. No. 62 (14). Pp. 3228-3241. 6. Application of the Pictet-Spengler reaction to aryl amine substrates linked to deactivated aromatic heterosystems / B. Saha et al. // Tetrahedron. 2008. No. 64 (37). 7. Facile construction of 1,2,6,7,12,12-p-hexahydroindolo[2,3-a] quinolizines via one-pot three-component reactions of tryptamines, propiolate, and a,e-unsaturated aromatic aldehydes or ketones / J. Sun et al. // Tetrahedron. 2013. No. 69 (26). Pp. 5451-5459. 8. Harmicines - harmine and cinnamic acid hybrids as novel antiplasmodial hits / I. Perkovic et al. // Eur. J. Med. Chem. 2020. 9. Herraiz T. // J. Agric. Food. Chem. 2000. Vol. 48(10). P. 4900 doi: 10.1021/jf000508l 10. Herraiz T., Galisteo J. // J. Agric. Food. Chem. 2003 Vol. 51 (24). P. 71561. 11. Piechowska P., Zawirska-Wojtasiak R., Mildner-Szkudlarz S. Nutrients. 2019. Vol. 11 (4). P. 814. 12. Preparation and antiprotozoal evaluation of promising в—carboline alkaloids / A. Gellis et al. // Biomed. Pharmacother. 2012. No. 66 (5). Pp. 339-347. 13. Puerto Galvis C., Kouznetsov V. Studies in Natural Products Chemistry // Elsevier. 2018. Vol. 56. P. 1. 14. Stereoselective preparation of pyridoxal 1,2,3,4-tetrahydro-p-carboline derivatives and the influence of their absolute and relative configuration on the proliferation of the malaria parasite Plasmodium falciparum / R. Brokamp et al. // Bioorg. Med. Chem. 2014. 22 (6). Pp. 1832-1837. 15. Synthesis of 1-indolyl substituted в—carboline natural products and discovery of antimalarial and cytotoxic activities / L. Liew et al. // Tetrahedron. 2014. No. 70 (33). Pp. 4910-4920. 16. Synthesis of в—carboline-fused 1,4-oxazepines and their assessment as antiplasmodial agents / V. Yadav et al. // Tetrahedron. 2017. No. 73 (38). Pp. 5680-5689. 17. Synthesis of fused polycyclic nitrogen-containing heterocycles via cascade cyclization / B. Saha et al. // Tetrahedron Lett. 2006. No. 47 (16). Pp. 2765-2769. 18. Synthesis of tetrahydro-e-carbolines, в-carbolines, and natural products, (±)-harmicine, eudistomin U and canthine by reductive Pictet Spengler cyclization / D. Pakhare et al. // Tetrahedron Lett. 2015. 19. The Carbolines / R. Abramovitch et al. // 1964. 20. The early preclinical and clinical development of cipargamin (KAE609), a novel antimalarial compound / S. Bouwman et al. // Travel MedInf. Disp. 2020. 21. Water as an efficient medium for the synthesis of tetrahydro-в-carbolines via Pictet-Spengler reactions / B. Saha et al. // Tetrahedron Lett. 2007. No. 48 (8). Pp. 1379-1383. Резюме. Актуальным направлением поиска лекарственных средств является модификация природных соединений, обладающих известной биологической активностью. Алкалоиды и их производные обладают немалым потенциалом трансформации в биологически активные структуры. Значительное число современных лекарственных веществ имеют в своей основе природное происхождение. Среди природных соединений алкалоиды представляют наиболее интересный класс химических веществ. Наши исследования направлены на создание противоинфекционных средств неантибиотической природы, что особенно важно в связи с возрастающей проблемой лекарственной устойчивости микроорганизмов. В условиях ТК «Химического синтеза новых лекарственных соединений» Северо-Кавказского зонального научно-исследовательского ветеринарного института проведены синтезы соединений ряда производных алкалоида бета-карболина. Синтезы осуществляли с помощью известных методов, описанных в руководствах по органической химии и в литературных источниках. Для всех соединений определяли уровень антипротозойной активности на модели инфузорий вида Colpoda steinii и показатели антибактериальной активности в отношении грамположительных бактерий St. aureus и грамотрицательных бактерий E.coli. Было установлено, что среди изученных производных алкалоида активными в отношении простейших оказались все синтезированные соединения, но уровень их активности был незначительным. Напротив, антибактериальная активность соединений оказалась более значимой. Все структуры были активны как в отношении грамположительных бактерий St. aureus, так и грамотрица-тельных E.coli. Уровень активности производных алкалоида бета-карболина в отношении St. aureus составлял 70,5% уровня активности фуразоли-дона и 50% уровня активности ципрофлоксацина; уровень активности в отношении E. coli составлял 66% уровня активности фуразолидона и 44% от уровня активности ципрофлоксацина. Ключевые слова: синтез производных алкалоида бета-карболина, скрининг антибактериальной и антипротозойной активности, колподы, кишечная палочка, золотистый стафилококк. Сведения об авторах: Зубенко Александр Александрович, доктор биологических наук, главный научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-928-6049743; e-mail: alexsandrzubenko@yandex.ru. Фетисов Леонид Николаевич, кандидат ветеринарных наук, ведущий научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-1978224; e-mail: fetisoff.leonid2018@yandex.ru. Авагян Элен Нверовна, лаборант-исследователь творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-1882434, e-mail: elen.avagyan.1999@inbox.ru. Диваева Людмила Николаевна, кандидат химических наук, ведущий научный сотрудник лаборатории органического синтеза НИИ ФГАОУ ВО «Южный федеральный университет»; 344090, г. Ростов-на-Дону, пр. Стачки, 194/2; тел.: 8-928-1756654; e-mail: divaevaln@mail.ru. Ответственный за переписку с редакцией: Святогорова Александра Евгеньевна, младший научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-988-9525755; e-mail: sviatogorova.a@yandex.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|