|
||||

Генетические технологии для сохранения биоресурсного потенциала сельскохозяйственных животныхУДК 619:636.082:606:636.03 Донник И. М., Макутина В. А., Исаева А. Г., Кривоногова А. С., Мымрин В. С. Федеральное государственное бюджетное В настоящее время технологии генной инженерии позволяют проводить полногеномный анализ племенных животных и определять наиболее ценных особей для дальнейшего воспроизводства. Кроме того, успешно проводится редактирование генов животных и растений, что позволяет в перспективе создавать линии животных с заданными морфологическими, физиологическими, продуктивными признаками, устойчивостью к заболеваниям [7, 12, 14, 19]. Но большинство работ по биоинформатическому анализу, разработке технологий редактирования генома проводится на лабораторных животных, а не на сельскохозяйственных. Вследствие этого, проблемой генной инженерии продуктивных животных является слабая изученность их геномов, а получение новых пород животных с улучшенными хозяйственно-значимыми признаками пока ведется с помощью методов классической селекции. Достоинства селекции - большой арсенал методов, многолетний опыт формирования, выведения, закрепления нужных признаков. Главным недостатком же является длительность - минимально необходимый для получения результата период исчисляется десятилетиями. Кроме того, перенос аллелей генов между породами может приводить к нарушению селекционного процесса и утрате одних ценных признаков при закреплении других. Этих недостатков лишены методы генной инженерии, преимуществами которых являются быстрота получения новых организмов (8-10 лет); точность внесения изменений в геном; возможность введения желательных аллельных вариантов генов, не затрагивая генотип породы в целом. Однако слабая изученность геномов и неразвитость технологий редактирования и процессинга клеток и эмбрионов сельскохозяйственных животных, особенно крупного рогатого скота, существенно замедляют прогресс в данной области и не позволяют в настоящее время полноценно внедрять генную инженерию продуктивных животных в племенную практику. В современном отечественном племенном животноводстве актуализировались отдельные проблемные вопросы, которые сдерживают развитие отрасли в целом [1, 3, 5, 9, 13]. Среди них: импортозависимость племенного материала; возрастающий инбридинг среди племенных животных; использование устаревших методов оценки племенной ценности животных; сокращение срока хозяйственного использования и сокращение в целом поголовья сельскохозяйственных животных; проблемы состояния здоровья животных (ветеринария). А также недостаточное научное сопровождение всего племенного животноводства и выработка отдельных стратегических и тактических предложений и путей решения. Медленное развитие и внедрение отечественных наукоемких технологий в области селекции, генетики и воспроизводства крупного рогатого скота снижает конкурентоспособность отечественных товаропроизводителей, делает невозможной объективную генетическую оценку племенной продукции, ввозимой в страну из-за рубежа, и не позволяет преодолеть зависимость отрасли от «иностранной генетики» [1, 3, 9]. Цель работы - анализ основных показателей животноводства на основании статистических отчетов. Материалы и методы исследований. Проанализированы отчеты научных организаций по выполнению тематик научноисследовательских работ по генетическим технологиям. Для проведения исследований по геномному редактированию эмбрионов крупного рогатого скота использовали технологию CRISPR/Cas9, несколько способов доставки системы редактирования в зиготу, в том числе трансдукцию аденоассоциированными вирусами AAV, инъекции плазмидной ДНК с закодированным участком Cas9 и микроинъекции РНК Cas9 и гидовых РНК в цитоплазму. Использовали комплекс лабораторно-клинических методов, включающих получение донорского материала, IVM-созревание ооцитов (in vitro maturation), оплодотворение и культивирование ранних до-имплантационных эмбрионов крупного рогатого скота, криоконсервирование ооцитов и зигот, микроманипуляции на ооцитах, зиготах и ранних эмбрионах животных, а также молекулярно-биологические методы разработки и тестирования эффективности систем редактирования; статистические данные обрабатывали с помощью программы «Statistica, v. 10.0». Результаты исследований и их обсуждение. Были исследованы основные проблемы современного отечественного животноводства. Наиболее актуальными выявлены следующие из них. Импортозависимость. Особенно остро вопрос стоит в молочном животноводстве. По данным информресурса www.Statistika. com, наиболее продуктивными являются коровы, разводимые США, средний удой в 2021 году составил 10 800 кг, в Японии -10 300 кг, Канаде - 10 293 кг, странах ЕС - 7 073 кг, в Беларуси - 5 593 кг, в России - 7 162 кг. При этом в Уральском регионе среднее значение - 7 504 кг (Свердловская область - 8 123 кг, Тюменская область - 7 843 кг, Удмуртия - 7 380 кг, Пермский край - 6 483 кг, Челябинская область - 5 906 кг, Курганская область - 5 156 кг). То есть, результаты молочной продуктивности отечественных коров вполне сравнимы с лучшими достижениями стран Евросоюза. В 80-х гг. было начато массовое скрещивание отечественных коров черно-пестрых, красно-пестрых с голштинскими, буро-швид-скими и другими производителями, улучшающими породу. Так, согласно Постановлению Совета Министров РСФСР от 19.09.1984 г. № 413, в стране за период 1985-1990 гг. численность помесного черно-пестрого скота и чистопородных голштинских животных должна была увеличиться в 7,5 раз, палево-пестрых помесей и чистопородных голштинских животных в 25 раз. Однако, наращивая объемы скрещивания, намечалось сохранить и развить племенную базу отечественного молочного скотоводства. Программой «О мерах по повышению интенсификации молочного животноводства в колхозах и совхозах РСФСР», одобренной Постановлением Совета Министров РСФСР от 21.05.1985 г. № 215, было предусмотрено осуществить работы по созданию новых высокопродуктивных типов, пород, линий и стад путем поглощения отечественного маточного поголовья голштинской, бурой швидской американской селекции, англерской и другими породами до кровности не более 75% (3/4) с последующим разведением помесей «в себе», при условии осеменения быками-улучшателями не менее 70% подконтрольного маточного поголовья. Для достижения цели перед Минсельхозом Российской Федерации и руководящими органами регионов страны была поставлена задача довести численность быков, находящихся на проверке по качеству потомства до 11,0 тыс. голов, выбор которых намечено осуществлять в соотношении - 1 из 13,2 выращенных животных. Но в 1986 году было принято решение, что быки с молочной продуктивностью выше 7 000 кг при 3,8% жира признаются улучшателями (категории А3) без проверки и оценки по потомству. Уже в 1986-89 гг. были признаны улучшателями 96% быков импортной селекции. Это негативно сказалось на быках отечественной селекции. Численность ежегодно выявляемых быков-у-лучшателей сразу сократилась в 3 раза. При этом, при проверке по качеству потомства быков зарубежного происхождения, лишь 41% были признаны улучшателями, а 59% были аттестованы как ухудшатели и нейтральные. Однако семя их не выбраковали и использовали, так как они формально считались улучшателями. В результате такого скрещивания у коров удой увеличился всего на 134 кг (4,4%), в то же время у первотелок от оцененных традиционно по качеству потомства быков - на 259 кг (7,7%). То есть, использование производителей-улучшателей было более эффективно, чем массовое скрещивание российского поголовья с зарубежными голштинскими производителями, признанными формально улучшателями (без оценки по качеству потомства). В 1989-2019 гг. импортным быкам присваивали все племенные категории не только А3, но и даже А1Б1 (абсолютный улучшатель), в том числе даже совсем молодым бычкам. В США уже три десятилетия ведется селекция на ограниченное количество быков и, как следствие, практически весь массив помесного скота образован линиями двух быков родоначальников (ВИС Бэк Айдиал 1013415 и Рефлекшн Соверинг 198998). Импортерам семени быков предлагали для завоза в Россию только генетический материал этих линий. Это создало не только угрозу генетической безопасности нашей страны, но и явную импор-тозависимость от поставок племенного материала из-за рубежа. Родоначальники линий не оказывают никакого влияния на современное состояние, так как находятся в 13-15 ряду предков. Современные быки-производители выводятся через так называемые ветви. Эти ветви давно перемешаны. При этом, из литературных источников известно, что в США и Канаде разводятся больше линий (6-8). Нарастание инбридинга приводит к сокращению продолжительности продуктивной жизни. Это обстоятельство снижает экономическую эффективность производителей молока в России. Для дальнейшего поддерживания генетического прогресса ежегодно требуется большее количество племенных телок и быков. В конечном варианте через 10-12 лет племенное животноводство может оказаться в тупике. В связи с этим одним из направлений могла бы быть закладка линий быков-производителей в племенных заводах по породам молочного скота таким образом, чтобы обеспечить наибольшую генетическую отдаленность по родственным генеалогическим связям в регионах. Для этого целесообразно в каждом округе заложить не менее 10 линий быков-производителей. Тщательный отбор лучших быков в 4-5 поколениях даст возможность сформировать в стране необходимое для устойчивого генетического развития число линий быков, которые будут отличаться не только по генеалогии, но и по климатическим условиям выращивания, что даст возможность обмена генетическим материалом между регионами в пределах одной породы. Такую работу невозможно провести без тщательного генетического скрининга с использованием современных технологических методов. Использование устаревших методов оценки племенной ценности животных. К наиболее сложной задаче, требующей первоочередного решения, следует отнести разработку и внедрение современных методов объективной оценки генотипа быков-производителей и коров на базе отечественных племенных ресурсов. В их числе: наилучший линейный несмещенный прогноз (BLUP), экономический селекционный индекс, использование маркерной селекции и геномного прогнозирования. За счет использования вариации данных методов, в сравнении с традиционной классной оценкой (бонитировкой), возможно ускорить селекционный процесс в 1,5-2,0 раза, повысить точность прогноза племенной ценности на 15-30% и тем самым сформировать задел для создания высокопродуктивных стад и селекционных групп животных с целью тиражирования лучших (выдающихся) генотипов животных. Но необходимо учитывать, что задача создания в России современной системы генетической оценки не может быть решена простым воспроизведением существующих зарубежных технологий. Разрабатываемые в зарубежных лабораториях технологии оценки генотипа не могут быть эффективно использованы (в некоторых случаях, напротив, могут оказать негативное влияние на развитие животноводства) вследствие различий между популяциями сельскохозяйственных животных России и зарубежных стран, а также в условиях внешней среды; в генетической структуре популяций; в подходах в определении признаков; в способах измерения хозяйственно-полезных признаков между популяциями сельскохозяйственных животных России и зарубежных стран; в целях селекции у различных стран; в генетических связях между российскими и зарубежными стадами. Учитывая существенные различия в природно-климатических условиях, зоотехнических, технологических и экономических параметрах между регионами страны, следует выделять несколько уровней разработки и внедрения систем оценки племенной ценности молочного скота: Региональный (один регион), Межрегиональный (группа регионов), Национальный (Россия в целом). В настоящее время при участии Национального исследовательского центра «Курчатовский институт» (НИЦ Курчатовский институт) создается система селекции национального стада крупного рогатого скота, которая базируется на расшифровке генома племенных животных и высокоточных информационно-аналитических системах (объем базы 70000 голов КРС). Система селекции поможет улучшать продуктивные качества животных, полностью отказаться от поставок зарубежного генетического материала, объем которого сейчас достигает более 90%. Важным аспектом использования генетических технологий является сохранение исчезающих отечественных пород крупного рогатого скота. По данным академика Н.А. Зиновьевой и ученых ВИЖа, поголовье всех отечественных пород резко сократилось и находится на грани исчезновения (табл. 1) [1, 6, 7, 8, 9, 10]. Таблица 1 Динамика поголовья отечественных пород крупного рогатого скота
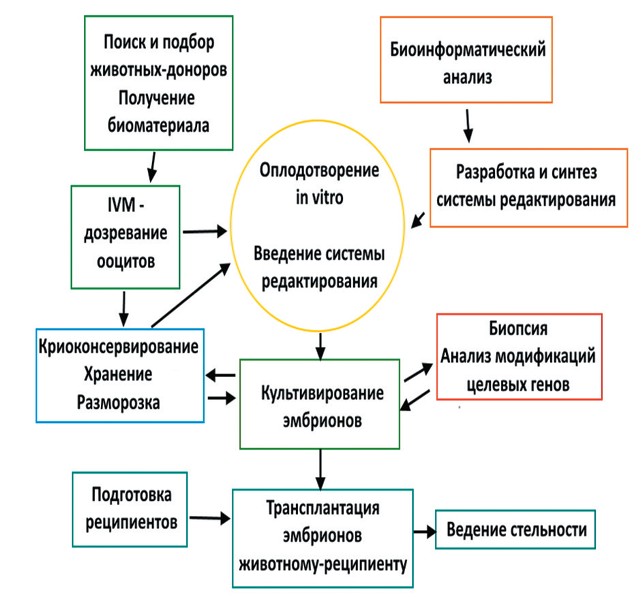
Для улучшения селекционной работы активно разрабатываются генетические современные технологии. Актуальные тематики научно-исследовательских работ по генетике наиболее полно представлены в Федеральном исследовательском центре животноводства - ВИЖе им. академика Л.К. Эрнста. Среди них такие направления, как совершенствование современных систем кормления животных, включая элементы кормопроизводства, изучение процессов регуляции репродукции и совершенствование эмбриональных биотехнологий как основы сохранения генетического биоразнообразия, повышения эффективности воспроизводства и создания новых селекционных форм животных и птицы; усовершенствование основных пород сельскохозяйственных животных, разработка предложений их разведения в направлении повышения продуктивного долголетия, создания новых генотипов и повышения эффективности их использования, а также изучение механизмов действия биологических маркеров, ассоциированных с репродуктивной функцией животных для совершенствования использования вспомогательных репродуктивных технологий. Внедрение результатов исследований позволит качественно улучшить племенное животноводство. В ряде других научных учреждений страны также идет поиск новых подходов к сохранению и развитию генетического потенциала продуктивных животных. Так перспективным методом для ускорения селекционного процесса может быть использование генного редактирования с использованием системы CRISPR/Cas9. Преимущества, предлагаемые системой CRISPR/Cas, настолько значительны, что в настоящее время методология редактирования генома изменилась в значительной степени по сравнению с традиционными методами (ZFN, TALEN). Данный метод апробирован на микроорганизмах, для трансформации систем доставки лекарственных веществ [17, 22]. Векторы систем CRISPR/Cas9 коммерчески доступны и могут быть нацелены на определенные области генома размером 20-30 п.н. В мире с помощью редактирования генома были получены животные с различными характеристиками (крупный рогатый скот с высокой устойчивостью к туберкулёзу, коровы с низким содержанием аллергенных белков в молоке, свиньи, овцы, козы с модифицированным геномом [19]. В целом, можно отметить, что у крупного рогатого скота успешных попыток модификаций генома целого животного/ эмбриона не так много. Кроме того, часто отмечается высокий уровень мозаицизма [12, 21, 23]. В России работы ведутся под руководством академика Н.А. Зиновьевой в ФИЦ ВИЖ им. Л.К. Эрнста - получены куры, овцы с нокаутом гена миостатина (MSTN), куры с модифицированными генами, отвечающими за рост и развитие оперения; линии клеток и эмбрионы крупного рогатого скота, нокаутные по генам BLG, MSTN. В Белгородском НОЦ получены линии кроликов с изменённым геномом для фармацевтических нужд. На Урале ведутся работы по созданию генно-редактированного крупного рогатого скота с изменёнными генами устойчивости к инфекциям и нокаутом гена бета-лактоглобулина (BLG). Система генного редактирования для получения сельскохозяйственных животных с улучшенными признаками была разработаны междисциплинарным научным коллективом Уральского федерального аграрного научно-исследовательского центра УрО РАН, Института биологии гена Российской академии наук, НОЦ «Инновационные решения в АПК» Белгородская область, ОАО «Уралплемцентр», при консультативной поддержке специалистов Центра семейной медицины г. Екатеринбурга (при поддержке Российского Научного Фонда). Самый «простой» способ создания модифицированных животных с заданными свойствами - это изменение генома их эмбрионов. Для достижения этой цели необходим синтез современных технологий в области эмбриологии, репродуктологии, ветеринарной медицины, генной инженерии, молекулярной биологии и биоинформатики. Была разработана методика исследования (рисунок 1), включающая основные этапы создания особей с изменённым геномом.
Рис. 1. Методика исследований для создания генно-редактированного крупного рогатого скота В качестве мишеней для редактирования были выбраны гены, кодирующие белок-рецептор CD209 и белок беталакто-глобулин молока (BLG). Рецептор CD209 распознает широкий спектр патогенов, участвует в механизмах развития инфекции, в том числе - лейкоза крупного рогатого скота. Лейкоз крупного рогатого скота - одна из наиболее распространенных инфекционных болезней крупного рогатого скота в мире и в России. С ней связан не только многомиллиардный ежегодный экономический ущерб отрасли сельского хозяйства. Есть сообщения о связи вируса лейкоза крупного рогатого скота и развитии рака молочной железы у женщин, а также некоторых неопластических заболеваний кроветворной системы человека [16, 17, 18]. Межклеточная молекула адгезии CD209 представляет собой лектиновый рецептор С-типа, специфически экспрессируется в дендритных клетках, макрофагах (и на высоком уровне в В-клетках) и ассоциирована с патогенезом Т-клеточного лейкоза человека (Т-КЛЧ). Экспериментально показано, что ERVW-1 связывается с CD209 [15, 24]. Являясь частью первой линии врожденного иммунитета, CD209 достаточно неспецифически распознает широкий круг возбудителей: вирусы, бактерии, грибы, протисты. Влияние CD209 на разные стадии инфекционного процесса показано для ВИЧ, вируса гепатита С, вируса Эбола, коронавирусов, микобактерий туберкулеза и ряда других патогенов. Недавно было показано, что у коров некоторые изоформы CD209 могут влиять на развитие устойчивости к заражению паратуберкулезом. Более того, сообщалось, что сверхэкспрессия CD209 в бычьих макрофагах in vitro приводит к усилению аденовирусной инфекции. Вышеизложенное свидетельствует о потенциальной возможности CD209 являться рецептором к ВЛ КРС [2, 4, 20]. Бета-лактоглобулин (BLG) - один из главных аллергенов коровьего молока. Получение нокаутов гена беталактоглобулина (BLG) потенциально может способствовать формированию линии животных, в молоке которых данный белок отсутствует. Для работ по редактированию генов крупного рогатого скота использовали донорский материал - яичники коров, которые отбирали постмортально, а также семя племенных быков. Из яичников получали ооцит-кумулюсные комплексы, которые культивировали по разработанным протоколам дозревания на специализированных средах с добавлением гормонов. Исследовали эффективность нескольких способов доставки системы редактирования в зиготу крупного рогатого скота: трансфекция плазмидной ДНК, содержащей CRISPR/Cas9; внесение системы CRISPR/Cas9 c гидовой РНК в виде плазмидной ДНК совместно со сперматозоидом при интрацитоплазматической микроинъекции сперматозоида в ооцит на стадии MII; трансдукция эмбрионов крупного рогатого скота с помощью аденоассоциированных вирусов (AAV) и микроинъекция в цитоплазму зиготы мРНК белка spCas9 и гидовых РНК [11]. В результате проведенных исследований наиболее успешными были трансдукция эмбрионов с помощью AAV (аденоассо-циированного вируса). При этом из пяти различных серотипов рекомбинантного AAV (AAV1, AAV2, AAV6, AAV9 и AAV-DJ) четыре показали очень близкую эффективность трансдукции (52,9458,33%), и серотип AAV2 впоследствии применили для нокаута CD209. Полученные в ходе эксперимента эмбрионы культивировали до стадии бластоцисты, затем секвенировали по Сэнгеру. Установили, что уровень нокаута целевого гена CD209 составил 14%. Таким образом, было установлено, что применение AAV-вектора для доставки системы редактирования являлось перспективным методом получения генетически модифицированных эмбрионов крупного рогатого скота. Более эффективной была методика микроинъекции в цитоплазму зиготы мРНК белка spCas9 и гидовых РНК. Было проведено несколько серии микроинъекций конструкций для редактирования генома ранних эмбрионов крупного рогатого скота. Был достигнут уровень бластуляции 5,5%-16%, уровень нокаутов по гену BLG составлял в среднем 29,4%, уровень нокаутов по гену CD209 20,0% - 22,2%. Оба эти способа могут быть использованы для получения нокаутов по генам интереса при редактировании генома крупного рогатого скота. Для подтверждения результатов был усовершенствован способ прижизненной биопсии бластоцисты эмбриона на 5 сутки развития с помощью микро манипуляционной установки Narishige (Япония) в комплекте с инвертированным микроскопом Nikon. Таким образом, результаты исследований показали возможность генного редактирования эмбрионов крупного рогатого скота с модификацией генов, ассоциированных с ценными хозяйственными и физиологическими признаками. В плане дальнейших работ предусмотрена трансплантация коровам-реципиентам полученных эмбрионов с редактированным геномом, а также отработка и совершенствование технологии генного редактирования с учетом видовой специфичности, дальнейшее изучение генома крупного рогатого скота и поиск актуальных мишеней для редактирования. Заключение. В целом, генные технологии перспективны, так как делают возможным ускорение селекционного процесса и сохранение генетического материала от высокоценных племенных сельскохозяйственных животных. Для дальнейшего развития и широкого применения технологий генной инженерии в животноводстве необходимы: совершенствование методов и методик; биоинформа-тический анализ и изучение геномов продуктивных животных; исследование функций конкретных белков и ассоциированных с ними генов животных; разработка и адаптация технологий процессинга и работы с клетками и эмбрионами хозяйственно-значимых видов животных, создание адаптированных к производственным условиям методов оценки, подготовки животных-доноров и реципиентов, разработка эффективных методов трансплантации модифицированных эмбрионов, ведения беременности и сохранения здоровья животных с модифицированным геномом, полученных с помощью in-vitro технологий. Все эти вопросы необходимо решать на основе глубоко научного поиска. Также необходимо активизировать разработку отечественных геномных индексов племенной ценности с учетом территориальных и климатических особенностей страны, совершенствовании отечественных пород продуктивных животных, разработке и совершенствованию методик контроля, особенно при ввозе в страну генно-изменённого племенного материала, сырья и сельскохозяйственной продукции. Исследование выполнено за счет гранта Российского научного фонда № 19-76-10022. Список литературы: 1. Амерханов, Х. А. Проблемы сохранения породного разнообразия сельскохозяйственных животных в Российской Федерации / Х. А. Амерханов, Е. М. Колдаева // Известия Международной академии аграрного образования. 2023. № 65. С. 158-161. 2. Генетическое маркирование признаков продуктивности крупного рогатого скота казахской белоголовой породы на основе полногеномного SNP-типирования / А. М. Ковальчук, Е. В. Белая, Ю. А. Юлдашбаев [и др.] // Зоотехния. 2022. № 2. С. 2-6. 3. Динамика импорта племенной продукции крупного рогатого скота в Российскую Федерацию / И. М. Дунин, С. Е. Тяпугин, Н. В. Семенова [и др.] // Зоотехния. 2022. № 11. С. 21-24. 4. Климов, Е. А. Поиск рецептора для проникновения в клетку вируса лейкоза крупного рогатого скота: системный анализ литературы и сигнальных путей / Е. А. Климов, А. А. Шевцова, С. Н. Ковальчук // Актуальная биотехнология. 2018. № 3. С. 402-405. 5. Молочная продуктивность коров-первотелок черно-пестрой, голштинской пород разной селекции и их помесей/ Ю. А. Юлдашбаев, В. И. Косилов, Б. Кадралиева [и др.] // Вестник Башкирского государственного аграрного университета. 2022. № 2 (62). С. 107-112. 6. Поиск отпечатков селекции в геноме генофондных пород крупного рогатого скота красного корня России / А. А. Сермягин, А. В. Доцев, А. С. Аб-дельманова [и др.] // Молочное и мясное скотоводство. 2022. № 3. С. 10-15. 7. Полногеномные исследования структуры популяций российских локальных пород черно-пестрого корня / А. С. Абдельманова, А. А. Сермя-гин, А. В. Доцев [и др.] // Генетика. 2022. Т. 58. № 7. С. 786-797. 8. Породы мира: суксунская порода / А. А. Сермягин, И. С. Турбина, О. Ю. Кавардакова [и др.] // Молочное и мясное скотоводство. 2022. № 2. С. 44. 9. Сохранение генетического разнообразия крупного рогатого скота - основа успешного развития животноводства / Х. А. Амерханов, Г. С. Шеховцев, Е. М. Колдаева [и др.] // Молочное и мясное скотоводство. 2023. № 1. С. 3-6. 10. Сравнительное исследование геномной архитектуры современных и исторических образцов двух российских пород крупного рогатого скота / Н. А. Зиновьева, А. С. Абдельманова, А. В. Доцев, [и др.] // В книге: Биотехнология: состояние и перспективы развития. материалы международного конгресса. Москва. 2021. С. 338-340. 11. AAV infection of bovine embryos: Novel, simple and effective tool for genome editing / A. S. Krivonogova, A. V. Bruter, V. A. Makutina et al. // Theriogenology. 2022. Vol. 193. pp. 77-86. 12. Application of CRISPR/Cas9 System in Establishing Large Animal Models / Y. Lin, J. Li, C. Li et al. // Front Cell Dev Biol. 2022. No. 10: 919155. 13. Assessment of genomic inbreeding in russian local and commercial dairy breeds of cattle / A. I. Mishina, A. S. Abdelmanova, A. V. Dotsev et al. // Journal of Animal Science. 2021. Vol. 99. No. S3. Pp. 227-228. 14. Assessment of the genetic resources of russian local cattle breeds by genome-wide snp analysis / A. S. Abdelmanova, A. V. Dotsev, A. A. Sermyagin et al. // Journal of Animal Science. 2021. Vol. 99. No. S3. P. 225. 15. A novel high throughput quantum dot-based fluorescence assay for quantitation of virus binding and attachment / K. Kampani, K. Quann, J. Ahuja et al. // J. Virol. Methods. 2007. Vol. 141. No. 2. Pp.125-1320. 16. Bovine leukemia virus DNA in human breast tissue / G. C. Buehring, H. M. Shen, H. M. Jensen et al. // Emerg Infect Dis. 2014. No. 20 (5). P. 772-782. 17. Cocoon-like self-degradable DNA nanoclew for anticancer drug delivery / W. Sun et al. // J Am Chem Soc. 2014. 136: 14722-14725. 18. Exposure to Bovine Leukemia Virus Is Associated with Breast Cancer: A Case-Control Study / G. C. Buehring, H. M. Shen, H. M. Jensen et al. // PLoS One. 2015. No. 10 (9): e0134304. 19. Generation of Cashmere Goats Carrying an EDAR Gene Mutant Using CRISPR-Cas9-Mediated Genome Editing / Fei Hao, Wei Yan, Xiaocong Li et al. // Int J Biol Sci. 2018. Pp. 427-436. 20. Molecular characterisation of the env gene from Brazilian field isolates of Bovine leukemia virus / M. F. Camargos, A. Pereda, D. Stancek et al. // Virus Genes. 2007. No. 34. Pp. 343-350. 21. Seamless modification of wild-type induced pluripotent stem cells to the natural CCR5Delta32 mutation confers resistance to HIV infection / L. Ye, J. Wang, A. Beyer et al. // Proc Natl Acad Sci USA. 2014. No. 111: 9591-9596. 22. Self-assembled DNA nanoclews for the efficient delivery of CRISPR-Cas9 for genome editing / W. Sun et al. // Angew Chem Int Ed Engl. 2015. No. 54: 12029-12033. 23. Somatic mosaicism and allele complexity induced by CRISPR/Cas9 RNA injections in mouse zygotes / S. Yen, M. Zhang, J. Deng et al. // Dev. Biol. 2014. No. 393: 3-9. 24. Synthesis, assembly, and processing of the Env ERVWE1/syncytin human endogenous retroviral envelope / V. Cheynet, A. Ruggieri, G. Oriol et al. // J. Virol. 2005. Vol. 79. No. 9. P. 5585-5593. Резюме. Приводятся проблемные вопросы современного молочного животноводства, восполнения племенных ресурсов. Обозначены и проанализированы ключевые проблемы отрасли - импортозависимость племенного материала, инбридинг, использование устаревших методов оценки племенной ценности животных, сокращение срока хозяйственного использования, ухудшение состояния здоровья высокопродуктивного поголовья, исчезновение отечественных пород скота. Показано, что современные генетические технологии позволяют не только сохранять биоразнообразие пород крупного рогатого скота и воспроизводить наиболее ценных животных, но и делают возможным ускорение селекционного процесса. Разработанная на основе CRISPR/Cas9 технология редактирования генома крупного рогатого скота позволила получить доимплантационные эмбрионы с нокаутными генами, кодирующими рецептор CD209 и аллергенный белок молока беталактоглобулин (BLG). Усовершенствованная и адаптированная с учетом видовой специфичности методика процессинга клеток крупного рогатого скота от взятия донорского биоматериала до криосохранения дозревших ооцитов и редактированных эмбрионов позволила достичь достаточно высокого уровня выживаемости зигот после редактирования. В зависимости от метода доставки системы редактирования уровень нокаутов составлял от 14% до 30%. Наиболее эффективными способами доставки CRISPR/Cas9 в зиготу были трансдукция ооцитов аденоассоциированным вирусом AAV2 и микроинъекция в цитоплазму зиготы РНК Cas9 и гидовых РНК против генов беталактоглобулина BLG и рецептора CD2O9. Методы генного редактирования перспективны для получения пригодных к трансплантации эмбрионов крупного рогатого скота с нужными хозяйственно значимыми признаками. Использование технологии генного редактирования крупного рогатого скота делает возможным узконаправленное изменение участков генома, ассоциированных с отдельными признаками при общем сохранении генетического потенциала наиболее ценных племенных сельскохозяйственных животных. Ключевые слова: селекция, племенное животноводство, генное редактирование, эмбрионы крупного рогатого скота, CRISPR/Cas9, беталак-тоглобулин, CD209, доставка системы редактирования, аденоассоцииро-ванный вирус, микроинъекция РНК. Сведения об авторах: Донник Ирина Михайловна, доктор биологических наук, профессор, академик РАН, главный научный сотрудник отдела мониторинга и прогнозирования инфекционных болезней ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; ktqrjp7@yandex.ru. Макутина Валерия Андреевна, кандидат биологических наук, старший научный сотрудник лаборатории геномных исследований и селекции животных ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; e-mail: makutina_v@rambler.ru. Кривоногова Анна Сергеевна, доктор биологических наук, доцент, ведущий научный сотрудник отдела лаборатории биологических технологий ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; тел: 8-343-2572044; e-mail: tel-89826512934@yandex.ru. Мымрин Владимир Сергеевич, доктор биологических наук, старший научный сотрудник лаборатории геномных исследований и селекции животных ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а; e-mail: mimrin@mail.ru. Ответственный за переписку с редакцией: Исаева Альбина Геннадьевна, доктор биологических наук, доцент, ведущий научный сотрудник отдела лаборатории биологических технологий ФГБНУ УрФАНИЦ УрО РАН; 620145, г. Екатеринбург, ул. Белинского, 112 а, тел: 8-343-2572044; e-mail: isaeva.05@bk.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|