|
||||

Эффективность применения пептидного биорегулятора сосудов для коррекции ориентировочно-исследовательского поведения у гипертензивных животныхУДК 636.028 Соколова И.Б. ФГБУ Институт физиологии имени И.П. Павлова РАН, г. Санкт-Петербург Введение. С развитием методов измерения кровяного давления у домашних животных и с повышением их продолжительности жизни артериальная гипертензия (далее, АГ) стала выходить на ведущие роли в истории болезни кошек и собак среднего и пожилого возраста. Доказано, что АГ приводит к морфологическим, метаболическим, биохимическим изменениям в тканях большинства органов, в том числе и в головном мозге [1]. В свою очередь, патологические изменения в центральной нервной системе являются основной причиной когнитивных, двигательных, поведенческих и эмоциональных нарушений. Разработка новых методов лечения АГ - важнейшая задача современных медицины и биологии. Проводить экспериментальные исследования целесообразнее на лабораторных, а не на домашних животных. Спонтанно гипертензивные крысы линии SHR являются моделью для изучения АГ. По мере развития АГ, у этих животных выявляются изменения в нейромедиаторных системах головного мозга (дофаминэргической, холинэргической, норадренэргической), которые участвуют в формировании и регулировании двигательной и исследовательской активности, внимания, запоминания [8, 9, 10].
Пептидный биорегулятор сосудов (ПБС) обладает ангиопротектив-ными свойствами [11]. Его применение при АГ способствует восстановлению микрососудистого русла и основных параметров микроциркуляции в головном мозге практически до уровня нормотензивных животных [4].
Цель исследования стало изучение эффективности применения пептидного биорегулятора сосудов для коррекции ориентировочно-исследовательского поведения при развитии артериальной гипертензии в течение года.
Материалы и методы исследования. Эксперименты проведены на спонтанно гипертензивных крысах-самцах линии SHR. Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище. Исследования проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных», принятых Европейской конвенцией 19.07.2014.
Пептидный биорегулятор сосудов Славинорм®, разработанный в Санкт-Петербургском институте биорегуляции и геронтологии, представляет собой комплекс полипептидов с молекулярной массой от 72 до 678 Да, экстрагированных из сосудов телят. В фармакопейной статье предприятия (ФСП) на лекарственный препарат Славинорм® действующее вещество обозначено следующим образом: полипептиды сосудов крупного рогатого скота.
Для представленного экспериментального исследования было сформировано 5 групп крыс-самцов линии SHR (табл. 1). Таблица 1 Экспериментальные группы спонтанно гипертензивных животных
Все курсы ПБС (0,25 мг) осуществляли внутримышечно по схеме: одна инъекция в сутки в течение 5 дней, перерыв двое суток, одна инъекция в сутки в течение 5 дней, всего 10 инъекций на курс.
Среднее артериальное давление (далее, АД) измеряли с помощью устройства для неинвазивного измерения АД у ненаркотизированных крыс, изготовленного в экспериментальных мастерских Института физиологии им. И.П. Павлова РАН.
Оценку поведения крыс линии SHR в возрасте 4, 6 и 12 месяцев проводили в установке «Открытое поле» («ОП», модель TS 0501, НПК «Открытая Наука»). Установка представляет собой арену (d=97 см), ограниченную непрозрачными бортами высотой 42 см, с 12 равномерно расположенными отверстиями в полу (d=2 см). Животное помещали в центр поля и в течение 3 мин регистрировали количество и последовательность всех поведенческих актов с помощью оригинальной программы «open field». Идентификацию актов проводили на основании классификации индивидуального поведения в «ОП»: «локомоция» - поступательное движение тела в горизонтальной плоскости; «обнюхивание» - принюхивание; «движение на месте» - повороты головы без существенных изменений координат корпуса в горизонтальной и вертикальной плоскостях; «груминг» - облизывание тела; «стойка с упором» - стойка на задних лапах с опорой на борта установки; «вертикальная стойка» - стойка на задних лапах в отдалении от бортов; «норка» - заглядывание в норку; «сидит» - неподвижность животного, обычно в позе сидя с подогнутыми конечностями и сгорбленной спиной [3].
У животных оценивали двигательную активность (количество актов «локомоция», «движение на месте», «сидит»), ориентировочно-исследовательское (количество актов «обнюхивание», «норка», «вертикальная стойка», «стойка с упором») и эмоциональное поведение (количество актов «груминг», «движение на месте», «вертикальная стойка»).
При статистической обработке достоверность различий двух выборок оценивали при помощи непараметрического U-критерия Манна-Уитни (программа Statistica v. 8) с уровнем достоверности (p<0,05) [2]. 25
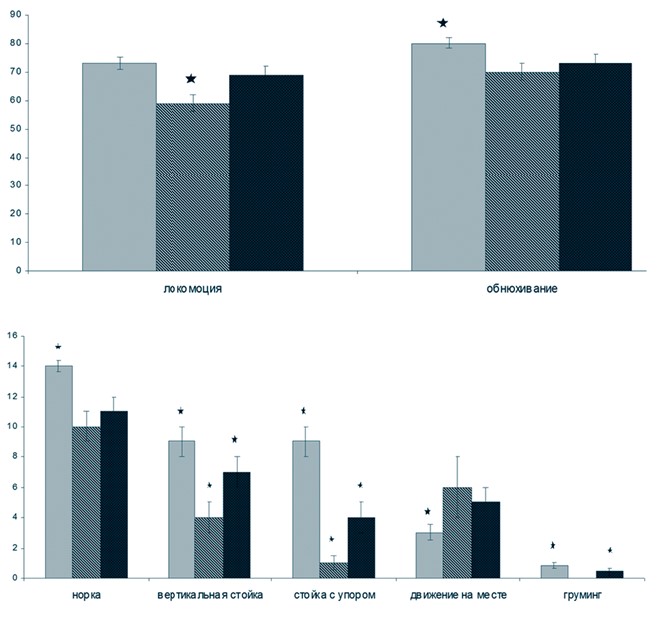
Результаты исследований и их обсуждение. Паттерны поведения в тесте «ОП» у крыс линии SHR в возрасте от 4 до 6 месяцев представлены на рисунке 1.
Рис. 1. Поведение спонтанно гипертензивных крыс в возрасте 4 и 6 месяцев в тесте «Открытое поле» (серая заливка - интактные SHR в возрасте 4 месяцев; черно-белая заливка - интактные SHR в возрасте 6 месяцев; черная с белыми точками - SHR в возрасте 6 месяцев, которым за 2 месяца до исследования (в возрасте 4 месяцев) был проведен один курс пептидного биорегулятора; по вертикальной оси - среднее количество актов поведения (± ошибка среднего); по горизонтальной оси -акты поведения; количество акта «сидит» во всех группах равно нулю; * - статистически значимые различия между группами животных (p < 0,05)) Показатели поведения в тесте «ОП» у интактных 6-месячных крыс SHR по сравнению с 4-месячными статистически достоверно снизились: в среднем в 1,2 раза уменьшилось количество акта «локомоция», что свидетельствует о снижении двигательной активности; количество актов «обнюхивание», «норка», «вертикальная стойка» и «стойка с упором» у животных в возрасте 6 месяцев также стало меньше в среднем в 1,1, 1,4, 2,3 и 9 раз, соответственно, то есть исследовательская мотивация и ориентировочное поведение угасали. По литературным данным, поведенческие нарушения у крыс линии SHR были зафиксированы уже в возрасте первых 4-10 недель жизни, когда АД еще практически не отличалось от такового у нормотен-зивных животных [7]. Повышение АД у крыс SHR фиксировали в возрасте примерно 6 недель. До 4 месяцев у данных животных не были выявлены морфологические изменения сосудистого русла головного мозга [12]. Иммуногистохимические исследования показали, что по мере взросления в стенке артерий неокортекса повышается иммунореактивность маркеров, указывающих на деградацию внеклеточного матрикса и замещение мышечных клеток коллагеновыми волокнами [6]. Вероятно, ухудшение мозгового кровообращения у 6-месячных SHR по сравнению с 4-месячными является одной из причин ухудшения ориентировочно-исследовательского поведения животных.
Применение одного курса пептидного биорегулятора Слави-норм® привело к статистически значимому увеличению количества актов: «локомоция» в среднем в 1,17 раза, «вертикальная стойка» - в 1,75 раза, «стойка с упором» - в 4 раза, «груминг» - на 50%. Мы предполагаем, что улучшение ориентировочно-исследовательского поведения крыс SHR после курса ПБС связано со значительным увеличением плотности микрососудистой сети, перфузии и тканевой сатурации кислородом в сенсомоторной коре головного мозга, как было показано в наших предыдущих работах [5]. Сенсомоторная кора (зоны передней теменной и собственно теменной области) является зоной представительства афферентации кожно-кинэстетического анализатора, ведущего в формировании приспособительных реакций грызунов. Следовательно, улучшение микроциркуляции в данной зоне головного мозга будет способствовать активации ориентировочно-исследовательского поведения гипертензивных животных. Однако, снижение количества актов вертикального поведения («вертикальная стойка», «стойка с упором») на фоне увеличения количества актов «движения на месте» и отсутствия акта «груминг» свидетельствует о негативном эмоциональном состоянии животных. У крыс один курс пептидного биорегулятора Славинорм® в большей степени нивелировал отрицательное эмоциональное поведение.
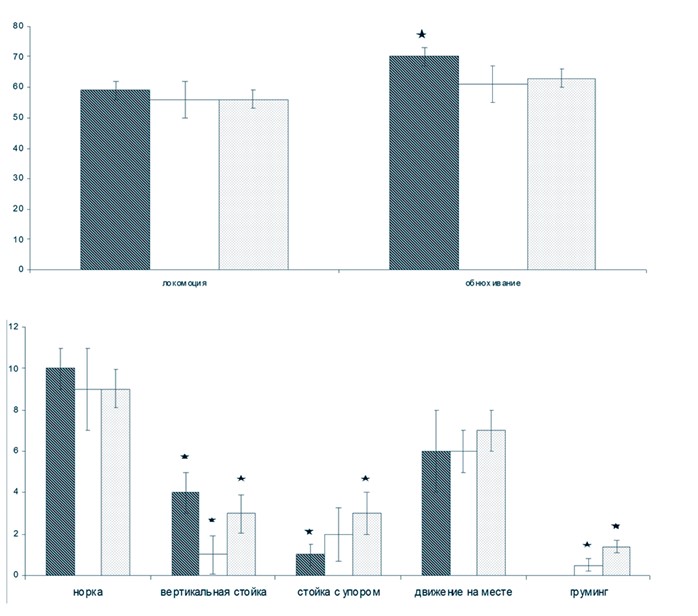
По литературным данным, к возрасту 12 месяцев у крыс линий SHRSP и SHR структура стенки мозговых артериол, артерий и крупных магистральных артерий (включая аорту) претерпевает существенные морфологические изменения - нарушается целостность эндотелиального слоя, часть эндотелиальных клеток погибает, у других наблюдаются деструктивные изменения. В результате у гипертензивных животных развивается эндотелиальная дисфункция [13]. Тем не менее, мы не наблюдали значимого ухудшения ориентировочноисследовательского поведения у крыс SHR в возрасте от 6 до 12 месяцев (рисунок 2 ).
Рис. 2. Поведение спонтанно гипертензивных крыс в возрасте 6 и 12 месяцев в тесте «Открытое поле» (серая заливка - интактные SHR в возрасте 6 месяцев; черно-белая заливка - интактные SHR в возрасте 12 месяцев; черная с белыми точками - SHR в возрасте 12 месяцев, которым за 2 месяца до исследования (в возрасте 10 месяцев) был проведен один курс пептидного биорегулятора; по вертикальной оси - среднее количество актов поведения (± ошибка среднего); по горизонтальной оси - акты поведения; количество акта «сидит» во всех группах равно нулю; * - статистически значимые различия между группами животных (p < 0,05)) Однако, количество акта «вертикальная стойка» уменьшилось примерно в 4 раза. После второго курса ПБС статистически значимо увеличилось количество актов: «вертикальная стойка» в среднем в 3 раза, «стойка с упором» - в 3 раза, «груминг» - в 2,8 раза. Повторный курс ПБС привел к увеличению плотности микрососудистой сети пиальной оболочки сенсомоторной коры у 12-месячных крыс по сравнению с интактными животными той же возрастной категории (в среднем в 1,6-1,7 раза), статистически значимому повышению таких показателей микроциркуляции в сенсомоторной коре, как перфузия и сатурация кислородом (табл. 2) [5].
Вероятно, даже на поздней стадии развития АГ применение ПБС для коррекции изменений ориентировочно-исследовательского поведения оказывается достаточно эффективным.
Итак, применение ПБС эффективно для улучшения мозговой микроциркуляции и коррекции ориентировочно-исследовательского поведения гипертензивных крыс на разных стадиях АГ. Результаты, полученные на грызунах, могут быть интерпретированы на другие виды домашних животных. Применение ПБС достаточно просто и может быть осуществлено в домашних условиях. Таблица 2 Основные показатели микроциркуляции в сенсомоторной коре головного мозга спонтанно гипертензивных животных [5]
Работа выполнена с использованием животных из биоколлекции ИФ РАН.
Авторы благодарят директора Санкт-Петербургского института биорегуляции и геронтологии член-корреспондента РАН В.Х. Хавинсона и его сотрудников за предоставление пептидного биорегулятора сосудов для проведения экспериментальных исследований.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2014-2020 годы (ГП-14, раздел 64).
Список литературы.
Резюме. Разработка новых методов лечения артериальной гипертонии - важнейшая задача современных медицины и биологии. Авторами была исследована эффективность применения пептидного биорегулятора сосудов для коррекции изменений ориентировочно-исследовательского поведения, происходящих при развитии артериальной гипертензии. Эксперименты проводились на спонтанно гипертензивных крысах-самцах линии SHR в возрасте от 4 до 12 месяцев. Оценку поведения крыс линии SHR проводили в установке «Открытое поле». Авторами показано, что артериальная гипертензия приводит к угасанию двигательной функции и исследовательской мотивации. С 4 до 6 месяцев уменьшилось количество актов «локомоция», «обнюхивание», «норка», «вертикальная стойка» и «стойка с упором» в среднем в 1,2, 1,1, 1,4, 2,3 и 9 раз, соответственно. С 6 до 12 месяцев не наблюдали значимого ухудшения ориентировочно-исследовательского поведения у крыс SHR. С помощью пептидного биорегулятора сосудов удалось восстановить количество основных поведенческих актов у гипертензивных животных в установке «Открытое поле» как в возрасте 6 («локомоция» в 1,17 раза, «вертикальная стойка» в 1,75 раза, «стойка с упором» в 4 раза, «груминг» на 50%), так и 12 месяцев («вертикальная стойка» в 3 раза, «стойка с упором» в 3 раза, «груминг» в 2,8 раза). Авторы считают, что улучшение ориентировочно-исследовательского поведения крыс SHR после курса применения пептидного биорегулятора сосудов связано со значительным увеличением плотности микрососудистой сети, перфузии и тканевой сатурации кислородом в сенсомоторной коре головного мозга. Результаты, полученные на грызунах, могут быть интерпретированы на другие виды домашних животных.
Ключевые слова: артериальная гипертензия, спонтанно гипертензивные крысы, пептидный биорегулятор сосудов, ориентировочно-исследовательское поведение, тест «Открытое поле».
Сведения об авторах:
Соколова Ирина Борисовна, старший научный сотрудник Института физиологии им. И.П. Павлова РАН; 199034, г. Санкт-Петербург, наб. Макарова, 6; тел.: 8-813-7071553; e-mail: sokolovaib@infran.ru.
Ответственный за переписку с редакцией: Федотова Ольга Ростиславовна, начальник сектора ФГУП «Научно-исследовательский институт прикладных проблем»; 191167, г. Санкт-Петербург, наб. Обводного канала, 29; тел.: 8-812-4067410 (доб. 2-417-1); e-mail: fedot2003@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|