УДК 576.89
DOI 10.33861/2071-8020-2025-3-33-35
Оригинальное эмпирическое исследование
Демидов О. П., Авакян Е. К., Побединская Д. Ю., Ермоленко А. П. Федеральное государственное автономное образовательное
учреждение высшего образования «Северо-Кавказский федеральный университет» г. Ставрополь
Святогорова А. Е., Грицай А. Ю. Северо-Кавказский зональный научноисследовательский ветеринарный институт -
филиал Федерального государственного бюджетного научного учреждения «Федеральный Ростовский
аграрный научный центр», г. Новочеркасск
Аннотация. На основе прямого окислительного SNH-ариламинирования метилтрифлатной соли 1-метил-6-нитрохинолина, а также 5-нитроизохинолина в безводном диметилсульфоксиде были получены неизученные ранее имины 1-метил-6-нитрохинолина, а в случае 5-ни-троизохинолина соответствующие нитро- и нитрозосоединения. Разработанный нами подход базируется на присоединении предварительно генерируемых анилид анионов к соответствующим субстратам, при этом не требуется какое-либо участие хорошо уходящих групп или применение катализаторов на основе тяжелых металлов. Диариламины на основе 5-нитрозоизохинолина подвергали в различных условиях внутримолекулярной гетероциклизации, приводящим к конденсированным производным изохинолина - пиридо[4,3-а]фена-зинам. Другая синтетическая модификация нитрозопроизводных изохинолина позволила получить нам N-оксиды 6-ариламино-5-нитро-изохинолина. Реакцию осуществляли обработкой соответствующих нитрозопроизводных м-хлорпербензойной кислотой при комнтаной температуре. Для всех полученных продуктов было выполнено исследование биологической активности. Изучали антибактериальную, фунгистатическую и протистоцидную активность. Проведённое исследование биологической активности полученных продуктов показало отсутствие фунгистатического эффекта. Тем не менее, у незамещенного пиридо[4,3-а]феназина выявлена умеренная протистоцидная активность, которую сравнивали с активностью фундазола. Интересно, что наличие заместителя в положении 10 приводит к полному отсутствию ее проявления. Все соединения продемонстрировали заметную бактериостатическую активность, достигающую примерно 60% от активности фуразолидона (использованного в качестве эталона, наряду с ципрофлоксацином для оценки антибактериальной активности). При этом наибольшая активность выявлена у бромзамещенного N-оксида 5-нитро-6-ариламиноизохинолина 8. Обращает на себя внимание умеренная антибактериальная активность всех представленных хинолиновых/изохинолиновых соединений, что делает поиск эффективных антибактериальных препаратов среди подобных структур перспективным направлением исследований.
Ключевые слова: хинолин, изохинолин, пиридо[4,3-а]феназин, антибактериальная активность, антипротозойная активность, фунгиста-тическая активность.
Современная фармацевтическая промышленность остро нуждается в новых антибактериальных и противовирусных препаратах. Распространение лекарственной резистентности у бактерий и микроорганизмов снижает эффективность существующих лекарств, ухудшая течение заболеваний. Поэтому разработка новых лекарственных средств является приоритетной задачей для исследователей [16].
Хинолиновый и изохинолиновый каркасы содержатся во многих физиологически активных алкалоидах (морфин, хинин), вследствие чего современные исследования сфокусированы на изучении производных данных гетероциклов как потенциально биологически активных соединений [12].
В недавних обзорных работах авторы показали актуальные подходы к методам синтеза различных производных хинолина и изохинолнина, обладающих противораковой [10], анти-нейроде-генеративной [5], а также противотуберкулезной [13] активностями. Кроме того, эти соединения могут рассматриваться как потенциальные противовирусные агенты против ВИЧ [9].
Анализ опубликованных работ демонстрирует также значительный интерес к исследованию антибактериальной и противогрибковой активности хинолиновых соединений. В частности, обзор 2021 года подробно анализирует взаимосвязь между структурными особенностями хинолиновых производных и их антимикробными свойствами [8], обсуждается перспективность использования хинолинового каркаса в качестве фармакофора для разработки противовоспалительных препаратов нового поколения, эффективных при лечении широкого спектра воспалительных заболеваний [11].
Ввиду актуальности изучения новых потенциально биологически активных соединений на основе хинолина и изохинолина, мы разработали новый подход к синтезу неизвестных ранее и труднодоступных производных данных гетероциклов на основе прямого нуклеофильного замещения водорода (ONSH реакции) [14, 15].
Исследования нашего коллектива направлены на изучение и разработку удобных методов синтеза новых соединений хинолинового и изохинолинового ряда, которые не требуют дорогостоящих реагентов, и при этом условия реакций соответствуют критериям экономичности всех параметров превращения [6], а также принципам «зеленой химии» [2], что является приоритетным для фармацевтических производств.
Целью данной работы является исследование противомикроб-ных и антибактериальных свойств синтезированных нами ранее [14, 15] потенциальных биологически активных производных 6-ни-трохинолина и тетрациклического производного изохинолина.
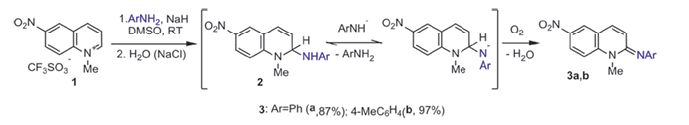
Материалы и методы исследований. Химическая часть. Ранее нами были найдены оптимальные условия, при которых соль 1-ме-тил-6-нитрохинолиния и 5-нитроизохинолин вступают в реакцию SNH-a-риламинирования. Ариламид-анион генерировали действием гидрида натрия в безводном ДМСО. Реакция протекает при комнатной температуре, без изоляции от кислорода воздуха с хорошими выходами.
В случае соли 1-метил-6-нитрохинолиния были получены неизвестные ранее имины 3 a, b (рисунок 1), а в случае 5-нитроизохи-нолина смесь нитро- и нитрозоизохинолинов. Соединения 6 далее подвергались внутримолекулярной циклизации, при этом использовались два подхода: кипячение в уксусной кислоте и кипячение в спиртовом растворе поташа. Оба метода позволяют получить неизвестные ранее пиридо[4,3-а]феназины 7a,b с хорошими выходами (рисунок 2). Далее в результате окисления нитрозоаминов 6, используя оксидирующий агент м-хлорпербензойную кислоту (mCPBA), нам удалось синтезировать и продукт двойного N-оксидирования 8.

Рис. 1. Схема получения иминов 3a,b
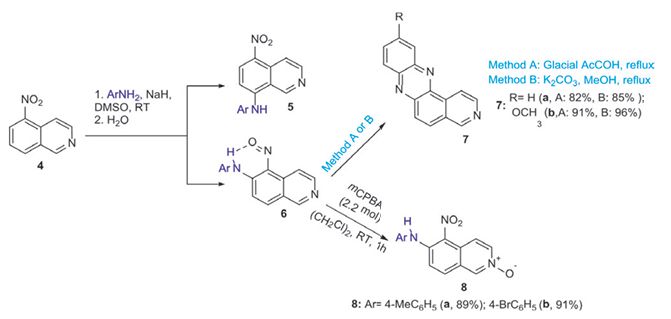
Рис. 2. Схема получения пиридо(4,3-а )феназина7а,b
Таким образом, с использованием найденных подходов, для последующего исследования биологической активности, нами были синтезированы шесть перспективных соединений с ожидаемым антибактериальным и антимикробным действием.
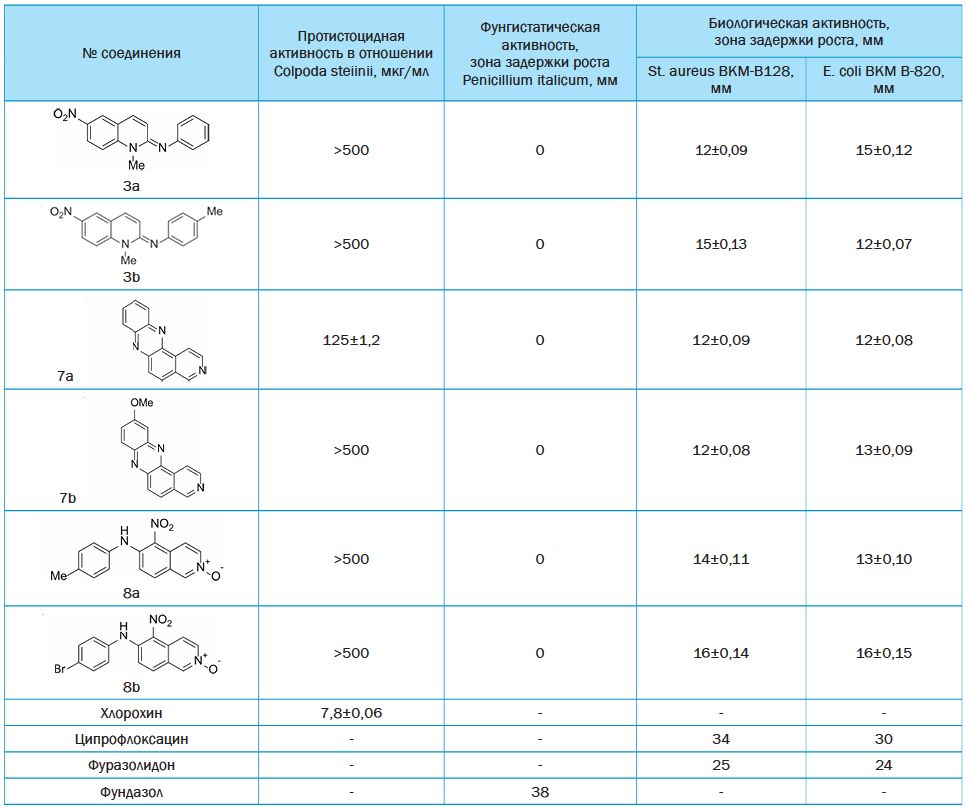
Таблица 1 Структуры новых производных 6-нитрохинолина, 5-нитроизохинолина и пиридо[4,3-а]феназина и их биологическая активность
Биологическая часть. Антибактериальное действие исследуемых соединений оценивали методом диффузии в агар на питательной среде «ГРМ-агар» (ТУ 9398-020-78095326-2006). Для этого использовали диски производства ФБУН НИИ эпидемиологии и микробиологии имени Пастера (Санкт-Петербург) диаметром 6 мм (НД-ПМП-1) из фильтр-картона. В качестве тест-культур были взяты штаммы E.coli ВКМ B-820 и St.aureus ВКМ B-128 из Всероссийской коллекции микроорганизмов (ВКМ, ФИЦ ПНЦБИ РАН). На каждый диск наносили по 15 мкг исследуемого вещества. Диски помещали на чашки Петри с питательным агаром, засеянным суточными культурами бактерий (5 единиц по оптическому стандарту). Антимикробную активность определяли по диаметру зон задержки роста бактерий. В качестве контрольных препаратов использовали фуразолидон и ципрофлоксацин. Методика описана в журнале Polyhedron [3].
Фунгистатическую активность оценивали диско-диффузионным методом на среде сусло-агар (WORT AGAR), используя культуру гриба Penicillium italicum ВКМ F-1279. Обработку результатов выполняли после 72 часов инкубации при 26°C. В качестве эталонного препарата использовали фундазол. Методика описана в журнале Polyhedron [4].
Протистоцидную активность исследовали на простейших Colpoda steinii (полевой изолят, коллекция лаборатории паразитологии СКЗНИВИ) методом серийных разведений. Контролем служил водный раствор хлорохина (делагил) в концентрации, аналогичной концентрации исследуемых соединений. Анализ проводили по методике [1, 7].
Результаты исследований и их обсуждение. Отметим, что среди исследованной выборки незначительную протистоцидную активность проявил только пиридофеназин 7а. Однако все соединения обладали антибактериальным эффектом, сопоставимым с активностью фура-золидона. Примечательно, что исследуемые вещества не проявили фунгистатической активности. Полученные результаты указывают на перспективность дальнейшего изучения производных хинолина и изохинолина, включая их конденсированные аналоги, в качестве источников новых биологически активных веществ (табл. 1).
Заключение. Таким образом, можно отметить антибактериальную активность в изученных образцах с уровнем активности от 12-16 мкг/мл. В случае соединения 7a обнаружена протисто-цидная активность, которая составляет 125±1,2 мкг/мл.
Исследование выполнено за счет гранта Российского научного фонда № 23-73-01105 «Новые подходы к синтезу пи-ридофеназинов на основе реакции SNH-ариламинирования».
Список литературы:
1. Фетисов Л. Н., Зубенко А. А., Бодряков А. Н. [и др.]. Изыскание протистоцид-ных средств. Вопросы нормативно-правового регулирования в ветеринарии. 2012; (4/1): 70-72.
2. Arends I., Sheldon R., Hanefeld U. Green Chemistry and Catalysis. Wiley-VCH: Weinheim. 2007.
3. Burlov A. S. et al. Complexes of zinc (ii) with n-[2-(hydroxyalkyliminomethyl) phenyl]-4-methylbenzenesulfonamides: synthesis, structure, photoluminescence properties and biological activity. Polyhedron. 2018; (144): 249-258.
4. Burlov A. S. et al. Synthesis, characterization, luminescent properties and biological activities of zinc complexes with bidentate azomethine Schiff-base ligands. Polyhedron. 2018; (154): 65-76.
5. Chauhan M. S. S., Umar T., Aulakh M. K. Quinolines: Privileged Scaffolds for Developing New Anti-neurodegenerative Agents. Chemistry Select. 2023; (8 (14): e202204960.
6. Clarke P.A., Santos S., Martin W. H. C. Combining pot, atom and step economy (PASE) in organic synthesis. Synthesis of tetrahydropyran-4-ones. Green Chem. 2007; (9): 438-440.
7. Matiukhina A. K. et al. Complexes of Mn(II) and Co(III) with 2-Amino-N‘-(pyridin-2-ylmethylene)benzohydrazide: Synthesis, Structure, and In Vitro Biological Activity. Russian Journal of General Chemistry. 2023; (93 S2): S596-S604.
8. Dorababu A. Recent update on antibacterial and antifungal activity of quinoline scaffolds. Archiv der Pharmazie. 2021; (354 (3): 2000232.
9. Hu S. et al. Quinolines and isoquinolines as HIV-1 inhibitors: Chemical structures, action targets, and biological activities. Bioorganic Chemistry. 2023, 136, 106549. DOI: 10.1016/j.bioorg.2023.106549.
10. Ilakiyalakshmi M., Napoleon A. A. Review on recent development of quinoline for anticancer activities. Arabian Journal of chemistry. 2022, 15, 11, 104168. DOI: 10.1016/j.arabjc.2022.10416.
11. Mukherjee S., Pal M. Quinolines: a new hope against inflammation. Drug Discovery Today 2013, 18, 389-398. D0I:10.1016/j.drudis.2012.11.003.2. Tackling drug-resistant infections globally: final report and recommendations; May 2016.
12. Musiol, R. An overview of quinoline as a privileged scaffold in cancer drug discovery. Expert Opin. Drug Discov. 2017, 12(6), 583-597. DOI: 10.1080/17460441.2017.1319357; (b) Bala M., Kumar S., Pratap K., Verma P.K., Padwad Y., Singh B. Bioactive isoquinoline alkaloids from Cissampelos pareira. Nat. Prod. Res. 2019, 33(5), 622-627. DOI: 10.1080/14786419.2017.1402319; (c) Huang Q.-Q., Bi J.-L., Sun Q.-Y., Yang F.-M., Wang Y.-H., Tang G.-H., Zhao F.-W., Wang H., Xu J.-J., Kennelly E. J., Long C.-L., Yin G.-F. Bioactive isoquinoline alkaloids from Corydalis saxicola. Planta Med. 2012, 78(1), 65-70. DOI: 10.1055/s-0031-1280126; (d) Giri P., Kumar G.S. Isoquinoline alkaloids and their binding with polyadenylic acid: potential basis of therapeutic action. Mini Rev. Med. Chem. 2010, 10(7), 568-577. DOI:10.2174/138955710791384009;. (e) Luo C., Wireko M.A., Wang H., Wu C., Wang Q., Zhang H., Cao Y. Isoquinolines: Important Cores in Many Marketed and Clinical Drugs. Anti-Cancer Agents Med. Chem. 2020; 20(18), 811-824. DOI:10.2174/1871520620666200424132248.
13. Pakhariya R. P., Bhatnagar A., Pemawat G. Quinoline analogs: multifaceted heterocyclic compounds with varied synthetic strategies and potent antitubercular properties. RSC advances. 2025, 15(5), 3646-3663. DOI:10.1039/D4RA08362H.
14. Pobedinskaya D. Y., Demidov O. P., Avakyan E. K., Borovleva A. A., Larin A. N., Ermolenko A. P., Borovlev I. V. A simple method for the synthesis of diarylamines containing a nitroso group in the ortho position based on the SNH arylamination of 5-nitroisoquinoline. Chemistry of Heterocyclic Compounds. 2024, 60(3), 161-168. DOI:10.1007/s10593-024-03313-3.
15. Pobedinskaya D. Y., Demidov O. P., Ermolenko A. P., Avakyan E. K., Borovleva A. A., Larin A. N., Borovlev I. V. The First Case of an Aryl Imination Reaction by Direct Nucleophilic Substitution of Hydrogen: Synthesis of 2-arylimino Derivatives for 1,2-dihydro-1-methyl-5 (6, 7, 8)-nitroquinolines. ChemistrySelect. 2025, 10(8), e202500278. DOI: 10.1002/slct.202500278.
16. Tackling drug-resistant infections globally: final report and recommendations; May 2016.
Сведения об авторах:
Авакян Елена Кимовна, кандидат химических наук, старший научный сотрудник департамента науки ФГАОУ ВО «Северо-Кавказский федеральный университет»; 355017, Ставропольский край, г. Ставрополь, ул. Пушкина, 1; тел.: 8-962-4126620; e-mail: awackyan.elena2015@yandex.ru.
Побединская Диана Юрьевна, кандидат химических наук, младший научный сотрудник департамента науки ФГАОУ ВО «Северо-Кавказский федеральный университет»; 355017, Ставропольский край, г. Ставрополь, ул. Пушкина, 1; тел.: 8-961-4713665; e-mail: pobedinskayad@mail.ru.
Ермоленко Артем Павлович, аспирант ФГАОУ ВО «Северо-Кавказский федеральный университет»; 355017, Ставропольский край, г. Ставрополь, ул. Пушкина, 1; тел.: 8-919-7338386; e-mail: artem.p.ermolenko@gmail.com.
Святогорова Александра Евгеньевна, кандидат сельскохозяйственных наук, ведущий научный сотрудник творческого коллектива по химическому синтезу новых лекарственных соединений Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-988-9525755; e-mail: sviatogorova.a@yandex.ru.
Грицай Анна Юрьевна, младший научный сотрудник творческого коллектива по изучению инфекционной патологии животных Северо-Кавказского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «Федеральный Ростовский аграрный научный центр»; 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0; тел.: 8-908-5102689; e-mail: tkhim.sintez@yandex.ru.
Ответственный за переписку с редакцией: Демидов Олег Петрович, доктор химических наук, доцент, главный научный сотрудник департамента науки ФГАОУ ВО «Северо-Кавказский федеральный университет»; 355017, Ставропольский край, г. Ставрополь, ул. Пушкина, 1; тел.: 8-988-7612680; e-mail: odemidov@gmail.com.
Вклад авторов:
Демидов О.П.: разработка концепции, административное руководство исследовательским проектом, валидация результатов, написание рукописи - рецензирование и редактирование.
Авакян Е.К.: курирование данных, получение финансирования, предоставление ресурсов, научное руководство, написание черновика рукописи.
Побединская Д.Ю.: разработка методологии.
Ермоленко А.П.: проведение исследования.
Святогорова А.Е.: формальный анализ, проведение исследования, визуализация.
Грицай А.Ю.: проведение исследования, визуализация.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
http://www.vetkuban.com/num3_202509.html