|
||||

Диагностика геморрагического энтерита индеек с использованием реакции диффузионной преципитацииУДК: 616.98:578.826.1-07:57.083.334:636.592 Оригинальное эмпирическое исследование Красков Д.А., Джавадов Э.Д., Тарлавин Н.В., Веретенников В.В. Федеральное государственное бюджетное образовательное Аннотация. В Российской Федерации напряженная ситуация в области диагностики такой иммунодепрессивной болезни, как геморрагический энтерит индеек. Существует только единственный зарегистрированный набор в России для проведения иммунофермент-ного анализа, именно поэтому необходимо создать новые способы диагностики и наборы для диагностики геморрагического энтерит индеек. В данной статье описана разработка набора для диагностики геморрагического энтерита индеек в реакции диффузионной преципитации. Все компоненты набора были сделаны на базе НКДЦ по птицеводству при кафедре эпизоотологии им. Урбана В.П. Была приготовлена среда для реакции диффузионной преципитации, подготовлены лунки и внесены компоненты набора, также набором были проверены сыворотки крови и селезенки присланные с птицеводческих хозяйств, и поставлены отрицательные контроли. Все компоненты реакции прореагировали между собой и были получены ожидаемые результаты. Ключевые слова: геморрагический энтерит индеек, реакция диффузионной преципитации, способ диагностики иммунодепрессивных болезней. В связи с интенсивным развитием промышленного птицеводства, возникновением новых и изменением уже известных инфекционных болезней птиц, против которых проводится профилактическая вакцинация, требуется разработка чувствительных, высокоспецифичных и поддающихся автоматизации методов оценки иммунного статуса птиц. Своевременный мониторинг инфекционных болезней птиц является неотъемлемой частью комплекса мероприятий, направленных на профилактику этих заболеваний, что предусматривает внедрение в практику диагностических исследований, отвечающих современному уровню развития науки. Высокая эффективность мониторинга инфекционных заболеваний может быть достигнута только в том случае, когда методы диагностики доступны для региональных и производственных лабораторий и широко применяются в их практической работе. Наиболее актуальным для промышленного индейководства является профилактика опасных болезней (список МЭБ) - ньюкаслской болезни, гриппа птиц и экономически значимых болезней индеек - геморрагического энтерита индеек, инфекционного энцефаломиелита птиц, респираторного микоплазмоза и микоплазменного синовита, вызываемых Mycoplasma gallisepticum (Mg) и Mycoplasma meleagridis (Mm). Геморрагический энтерит индеек (далее, ГЭИ) - это высококонтагиозная и иммунодепрессивная инфекционная болезнь, вызванная ДНК содержащим вирусом из второй группы птичьих аденовирусов, семейства Adenoviridae, рода Siadenovirus, поражающая в основном индеек и фазанов [1, 2, 3, 4, 7]. Данная болезнь характеризуется депрессией, диареей с примесью крови в помёте, обезвоживанием, снижением температуры тела и различными осложнениями от секундарной микрофлоры [5]. Основными способами подтверждения данной болезни являются следующие серологические методы диагностики: реакция нейтрализации (далее, РН); реакция диффузной преципитации (далее, РДП); иммуноферментный анализ (далее, ИФА), а также молекулярно-биологические методы [6]. Геморрагический энтерит индеек может протекать сверхостро, остро и подостро. При сверхострой форме болезнь начинается внезапно, без проявления клинических и патологоанатомических признаков, и птица погибает в течение суток [8]. При острой и подострой форме развиваются депрессия, диарея, появляются кровяные сгустки в помете, а также на коже и перьях в области клоаки; температура тела снижена; происходит обезвоживание. Смертность наступает через 5-6 дней после возникновения кровавого помета. Летальность колеблется от 10 до 60 % (в экспериментальных условиях летальность доходила до 80-100%), клинические признаки исчезают через 6-10 дней после их манифестации. В настоящее время за рубежом существует множество зарегистрированных диагностических наборов, а также способов и методов диагностики ГЭИ [9]. В Российской Федерации по нашим данным есть только один зарегистрированный серологический набор на ГЭИ (набор для проведения иммуноферментного анализа), и отсутствуют другие способы и методы диагностики [10]. Иммуноферментный анализ имеет преимущества: более чувствительный метод (в 1000 раз по сравнению с РДП), результат можно получить за короткое время (около 3-4 часов), однако он же и имеет недостатки перед реакцией диффузной преципитации (РДП), а именно: высокая цена проводимых исследований, необходимость наличия специального дорогостоящего оборудования, необходимость в обученном персонале, большие риски получить ложный результат при допущение малейших ошибок. РДП можно провести, не имея специального оборудования в «полевых условиях», не нужно проводить курсы для обучения персонала данному методу (очень прост в понимании и использовании), компоненты набора обладают низкой ценой. Именно поэтому целью исследований являлось создание набора для реакции диффузной преципитации на геморрагический энтерит индеек, который раньше не был разработан и не был зарегистрирован в Российской Федерации. Материалы и методы исследований. Исследования и разработка способа диагностики были выполнены на базе Научно-консультационного диагностического центра по птицеводству кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО СПБГУВМ. Материалами для набора послужили: 1) положительный инактивированный антиген, супернатант гомогената селезенки индейки 28-дневного возраста в количестве 10 штук зараженной штаммом вируса геморрагического энтерита индеек «DK-24», семейства Adenoviridae, рода Siadenovirus № 110 (коллекции штаммов - возбудителей особо опасных болезней, используемых в ветеринарии и животноводстве ФГБНУ «ФЦТРБ - ВНИВИ») для производства диагностикумов, инактивированных и рекомбинантных вакцин; 2) положительная сыворотка крови с антителами на ГЭИ (полученная путем гипериммунизации индеек живой вакциной «Dindoral» |(Merial, Франция) - вакцинация проводилась дважды начиная с 28 дневного возраста с интервалом 14 дней, после чего отбор сыворотки крови проводился через 3 недели после второй иммунизации, титр антител контролировался с помощью ИФА набора: «ИФА Бест-Вет AT-HEV»); 3) отрицательный антиген, супернатант гомогената селезенки не зараженной индейки 28 дневного возраста в количестве 10 штук; 4) отрицательная сыворотка крови, сыворотка крови не вакцинированной индейки; 5) агаро-солевая смесь (состоящая из 1 г агара «Дифко» (Becton Dickinson, США) и 8 г NaCl). Перед постановкой реакции готовили среду для РДП путем смешивания 1 г агара «Дифко» (Becton Dickinson, США) и 8 г NaCl и добавляли 100 мл дистиллированной воды после чего ставили колбу с агара-солевым раствором на плиту и кипятили до того состояния, пока пена агара не начнёт подниматься вверх, после чего убираем колбу с плиты, ждем пока он опустится и снова кипятили, и так 3 раза. После остывание агара до 55-60°С разливали его по чашкам Петри так, чтобы уровень агара в чашке равнялся 5 мм, и ждали пока он остынет. После отвердевания клали в чашку Петри с агаром вату, смоченную водой. Для получения лунок в агаре использовали специальный пробойник (рисунок 1). После пробития из полученных лунок доставали агар. Чашка Петри с агаром была готова к работе. В зависимости от цели реакции (определения антигена в патологическом материале или определение титра антител) подготавливали компоненты реакции, которые нам надо исследовать, путём последовательного двукратного разведения (положительную сыворотку и антиген титровать ненужно, так как они уже разведены до рабочей концентрации). Раскапывали нужные нам компоненты по лункам. Если нам нужно определить титр вируса, то в центр закапывали положительную сыворотку, а по периферии раститрованный искомый антиген. Если же нам необходимо определить титр антител, то в центр закапывали заранее известный антиген, а по периферии рас-титрованную исследуемую сыворотку. На рисунках в лунках №№ 1-4: 1) в центре антиген в рабочем разведении и по периферии раститрованная сыворотка, полученная от индеек с птицефабрики, иммунизированных вакциной против ГЭИ; 2) в центре антитела в рабочем разведение и по периферии раститрованный антиген полученных от индеек с птицехозяйства в котором был подтвержден ГЭИ; 3) в центре антиген в рабочем разведение и по периферии раститрованная сыворотка из набора; 4) в центре антитела в рабочем разведение и по периферии раститрованный антиген из набора. А в лунках №№ 5-6 отрицательный контроль (рисунок 2). Предварительный учёт результатов проводится через 24 и 48 часов после постановки реакции, окончательный - через 72 часа. Положительным результатом считается образовавшиеся белая полоса преципитации между центральной и периферической лункой.
Рис. 1. Пробойник для получения лунок в агаров геле
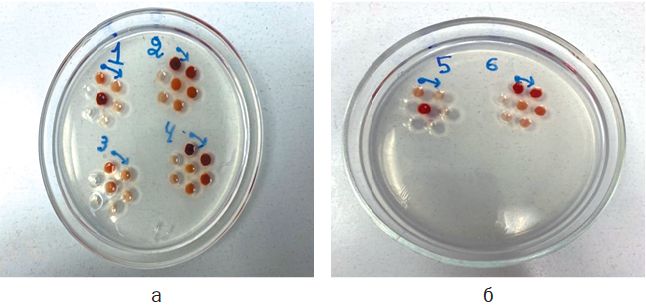
Рис. 2. Раскапанные компоненты набора: а - №№ 1-4 находятся положительные и исследуемые сыворотки и антиген; б - в лунках №№ 5-6 отрицательный контроль. Результаты исследований и их обсуждение. Через 72 часа был проведён учет результатов с поставленным компонентами в реакции (рисунок 3, 4).
Рис. 3. Учёт реакции в лунках №№ 1-4
Рис. 4. Учёт реакции в лунках №№ 5-6 Исходя из рисунков 3 и 4 мы видим, что в лунках № 1 - титр исследуемой сыворотки составляет 1:4; № 2 - титр исследуемого антигена составил 1:32; № 3 - титр рабочей сыворотки составил 1:4; № 4 - титр рабочего антигена составил 1:32; №№ 5-6 - отрицательный результат. Заключение. Исходя из результатов исследований, было установлено, что данный способ диагностики подход для проведения исследований как на наличие антител к геморрагическому энтериту индеек, так и на наличие антигена в органах-мишенях. Компоненты набора были правильно подобраны, а также было правильно подобрано рабочее разведение, и положительно прореагировали между собой, образуя полосу преципитации. Также положительные результаты показало исследование данным набором антител от индеек с птицефабрики, и антигена полученного с птицеводческого хозяйства, неблагополучного по данной болезни, что говорит о том, что его можно применять в лабораториях крупных птицефабриках, и в фермерских хозяйствах для постановки диагноза. Исследование выполнено за счет гранта Российского научного фонда № 24-26-20116 «Разработка отечественных серологических тест-систем для диагностики иммунодепрессивных болезней птиц» и Санкт-Петербургского научного фонда. Список литературы: 1. Джавадов Э.Д., Красков Д.А. Геморрагический энтерит индеек. БИО. 2021; (7 (250): 16-19. 2. Красков Д.А., Джавадов Э.Д., Веретенников В.В. [и др.]. Изучение биологических свойств возбудителя геморрагического энтерита индеек. Международный вестник ветеринарии. 2024; (4): 52-58. 3. Красков Д.А. Геморрагический энтерит индеек. Современные представления о болезни. Ветеринария в АПК. 2024: 83-85. 4. Джавадов Э.Д., Красков Д.А., Веретенников В.В., Тарлавин Н.В. Мраморная селезенка фазанов: патогенез, диагностика, лечение и профилактика. БИО. 2021; (9 (252): 4-6. 5. Джавадов Э.Д., Тарлавин Н.В., Веретенников В.В., Красков Д.А. Определение реактивности иммунитета индейки с помощью нитросинего тетразолия. Актуальные проблемы ветеринарной медицины: сборник научных трудов. 2022; (153): 19-23. 6. Красков Д.А., Джавадов Э.Д., Веретенников В.В., Тарлавин Н.В. Разработка молекулярно-биологического способа диагностики геморрагического энтерита индеек. Нормативно-правовое регулирование в ветеринарии. 2024; (4): 37-39. 7. Хлып Д. Н. Аденовирусные инфекции: геморрагический энтерит индеек. БИО. 2019; (3 (222): 16-18. 8. Dhama, K., Gowthaman, V., Karthik, K., Tiwari, R., Sachan, S., Kumar, M. A., Munir, M. Haemorrhagic enteritis of turkeys - current knowledge. Veterinary Quarterly. 2017; (37 (1): 31-42. 9. Koncicki A., Tykalowski B., Stenzel T., Smialek M., Pestka D. Effect of infection of turkeys with haemorrhagic enteritis adenovirus isolate on the selected parameters of cellular immunity and the course of colibacillosis. Pol J Vet Sci. 2012; (15 (2): 215-220. 10. Rautenschlein S., Sharma J.M. Immunopathogenesis of haemorrhagic enteritis virus (HEV) in turkeys. Dev Comp Immunol. 2000; (24 (2-3): 237-246. Сведения об авторах: Джавадов Эдуард Джавадович, академик РАН, доктор ветеринарных наук, профессор, профессор кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-9666774; e-mail: vnivip1@mail.ru. Тарлавин Николай Владимирович, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8430353; e-mail: tarlav1995@bk.ru. Веретенников Владислав Валерьевич, кандидат ветеринарных наук, ассистент кафедры эпизоотологии им. В.П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-981-8778769; e-mail: vlad.veretennikov.96@mail.ru. Ответственный за переписку с редакцией: Красков Дмитрий Андреевич, аспирант кафедры эпизоотологии им. В. П. Урбана ФГБОУ ВО «Санкт-Петербургский государственный университет ветеринарной медицины»; 196084, г. Санкт-Петербург, ул. Черниговская, 5; тел.: 8-921-4152266; e-mail: kraskov-00@bk.ru. Заявленный вклад авторов: Красков Д.А.: разработка концепции, проведение исследования, разработка методологии, визуализация, написание черновика рукописи; Джавадов Э.Д.: разработка концепции, научное руководство, написание рукописи - редактирование; Тарлавин Н.В.: предоставление ресурсов, валидация результатов; Веретенников В.В.: проведение исследования, получение финансирования. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|