УДК 619:616.636.4;59.006
DOI 10.33861/2071-8020-2025-3-17-21
Оригинальное эмпирическое исследование
Алиев А.Ю. Прикаспийский зональный научноисследовательский ветеринарный институт - филиал Федерального
государственного бюджетного научного учреждения «Федеральный аграрный научный центр
Республики Дагестан», Республика Дагестан, г. Махачкала
Федотов С.В., Латынина Е.С., Садыхов Э.Ф. Федеральное государственное бюджетное образовательное учреждение
высшего образования «Российский государственный аграрный университет -
МСХА имени К.А. Тимирязева», г. Москва
Аннотация. В крупных свиноводческих хозяйствах при интенсивном методе выращивания идет широкое применение антибиотиков, в том числе в целях стимулирования роста. Для сниженного использования антибиотиков в свиноводстве необходимо внедрение альтернативных препаратов, поддерживающих здоровье большого количества животных и приплода. К данной группе препаратов относят иммуномодулирующие соединения. Целью исследований явилось определение терапевтической эффективности нового иммуностимулирующего препарата, содержащего лизаты пробиотических бактерий, на ремонтных свинках. На 30-й день после введения исследуемого иммуностимулятора у свиней достоверно увеличиваются гематологические, биохимические и иммунологические показатели. Во всех опытных группах поросят выражено увеличение естественной резистентности, на что указывает повышение фагоцитарной активности нейтрофилов и лизоцимной активности сыворотки крови. Применение препарата способствует активации работы иммунной системы свиней. На протяжении эксперимента при введении исследуемого иммуномодулятора иммуноглобулин А вырос вдвое. Также отмечен существенный рост числа IgG, IgM. Получившие препарат животные продемонстрировали рост IgG с последующим увеличением, а также рост на более чем семьдесят процентов IgM и IgA.
Ключевые слова: свиньи, иммуномодулятор, лимфоциты, фагоцитарная активность крови.
Свиноводство занимает важное место в аграрном секторе, обеспечивая значительную долю производ-ства мяса в мире [6]. С увеличением населения и растущим спросом на мясные продукты, свиноводство становится не только экономически выгодным, но и социально необходимым. В России, как и в других странах, свиноводство представляет собой стратегически важную отрасль, способствующую продовольственной безопасности. Однако для достижения высоких показателей продуктивности необходимо учитывать множество факторов, включая генетику, кормление и ветеринарные мероприятия [7].
Одним из ключевых аспектов успешного свиноводства являются ветеринарные мероприятия. Они направлены на предотвращение заболеваний, улучшение здоровья животных и повышение качества продукции. Эффективная ветеринарная помощь включает в себя регулярные осмотры, вакцинацию и контроль за состоянием окружающей среды. Это особенно важно в условиях современных вызовов, таких как вспышки инфекционных заболеваний, которые могут негативно сказаться на поголовье.
Кроме того, важно учитывать влияние свиноводства на экологию. Современные подходы к ведению хозяйства позволяют минимизировать негативное воздействие на окружающую среду. Интеграция ветеринарных мероприятий с принципами устойчивого развития может значительно повысить эффективность производства [10].
Таким образом, актуальность свиноводства и ветеринарных мероприятий не вызывает сомнений. Эта отрасль требует ком
плексного подхода, включающего как научные исследования, так и практическое применение полученных знаний. В условиях глобализации и изменения климата необходимо адаптироваться к новым вызовам и использовать инновационные технологии для повышения продуктивности и устойчивости [1, 11].
В крупных свиноводческих хозяйствах при интенсивном методе выращивания идет широкое применение антибиотиков, в том числе в целях стимулирования роста [2]. Для сниженного использования антибиотиков в свиноводстве необходимо внедрение альтернативных препаратов, поддерживающих здоровье большого количества животных и приплода [1]. К данной группе препаратов относят иммуномодулирующие соединения [3].
К иммуномодуляторам относят различные биологически активные вещества, влияющие на иммунитет путем усиления функции защитной системы организма, приводя патологически измененный иммунный ответ в физиологическую норму [3]
В настоящее время есть препараты, избирательно действующие на различные звенья иммунной системы, в частности, лекарственный препарат Иммуномакс®, который активирует рецептор TLR4 на макрофагах и дендритных клетках [4, 9].
Для нормализации функций иммунной системы разработаны и успешно применяются иммуномодуляторы и природного происхождения [8]. На основе продукта криофракционирования селезенки крупного рогатого скота и интерферона свиного рекомбинантного, создан препарат аминоселеферон [5, 10].
Применение нормализующих иммунитет препаратов и кормовых добавок в условиях промышленного свиноводства должно сочетаться с целым комплексом условий их содержания. Необходимо получить таких животных, которые бы при должном уровне кормления дали максимальный прирост живой массы и, если это самки, соответствующий экономически эффективный за счет выхода поросят.
Целью исследований явилось определение терапевтической эффективности нового иммуностимулирующего препарата, содержащего лизаты пробиотических бактерий, на ремонтных свинках.
Материалы и методы исследований. Работа выполнена за счет средств Программы развития университета в рамках программы стратегического академического лидерства «Приоритет-2030». В исследовании участвовали поросята группы доращивания. Всего в исследовании участвовало 120 голов (60 контрольных и 60 подопытных) свиней. Все животные были выращены на территории ООО СПК «Машкино», во время исследования не перемещались и находились в стандартных условиях содержания. Пол: самцы. Возраст: 22-113 суток. Масса: 7-29 кг. Условия содержания: удовлетворительные. Условия кормления: полнорационный комбикорм, гранулированный для поросят МегаПиг Баланс 63813.
В исследование включали клинически здоровых животных. После комплектования групп, перед началом применения исследуемого лекарственного препарата (0 точка) от поросят (n=30) опытной и контрольной групп отбирали кровь для гематологических и иммунологических исследований (клинический анализ крови развернутый, Т- и B-лимфоциты, фагоцитарная активность крови, IgG и IgA).
Отбор проб крови произведили в вакуумные пробирки с активатором свертывания и в вакуумные пробирки с антикоагулянтом по 7 мл на каждую пробу.
Животным опытной группы с первого дня исследования применяли испытуемый лекарственный препарат, содержащий лизаты пробиотических бактерий, ежедневно в смеси с кормом в дозе 0,6 г на 1 кг корма тремя курсами по 14 дней каждый с интервалом 21 день. Не допускали применения исследуемого препарата совместно с плановыми вакцинациями и антибиотиками для исключения искажения результатов исследования.
Животные контрольной группы не получали исследуемый препарат на протяжении всего эксперимента.
Для оценки эффективности вели наблюдение за обеими группами животных на протяжении всего периода доращивания. В этот период учитывали сохранность, массу тела поросят (в начале и конце доращивания) учет клинических признаков патологий, характерных для гемофильной и стрептококковой инфекции на всей продолжительности исследования. Взвешивание поросят производили после отбора крови для предотвращения искажения результатов лабораторных исследований на фоне стресса у животных.
На 0, 8, 15 и 22 сутки с начала каждого курса приема препарата отбирали кровь от поросят каждой (n=30) группы для гематологических и иммунологических исследований (клинический анализ крови развернутый, Т- и B-лимфоциты, фагоцитарная активность крови, IgG и IgA).
На основании результатов клинического статуса, заболеваемости, результатов лабораторных исследований, сохранности поросят и результатов зоотехнических показателей провели анализ профилактической эффективности применения лекарственного препарата.
Исследования цельной крови проводились на автоматическом гематологическом анализаторе Abacus 5 Vet, № 245000343, 2022 (Diatron MI Zrt., Венгрия).
Биохимические исследования показателей крови проводили на ветеринарном биохимическом анализаторе SKYLA VB1 (Skyla Corporation Hsinchu Science Park Branch, Тайвань), мод. VB-R01, № S1H2303060011, 2022 с применением диагностических панелей и картриджей для анализаторов Skyla VB1 (Skyla Corporation Hsinchu Science Park Branch, Тайвань)
Определение уровня фагоцитоза. Фагоцитарная активность (ФА) - количество активных нейтрофилов из 100 подсчитанных.
Фагоцитарный индекс (ФИ) - число микробных клеток (м.к.) в пересчете на один нейтрофил от общего количества подсчитанных нейтрофилов.
Фагоцитарное число (ФЧ) - число микробных клеток в пересчете на один активный (фагоцитирующий) нейтрофил.
Фагоцитарная емкость (ФЕ) - число фагоцитирующих нейтрофилов в 1 мкл крови животного.
Методика дифференцировки Т- и В-лимфоцитов. Клеточноопосредованный и гуморальный иммунитеты обеспечивают два типа лимфоцитов - Т- и В-лимфоциты. Хотя при исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаковыми, эти клетки подразделяют на две основные популяции. Одна популяция - Т-лимфоциты - ответственна за формирование активированных лимфоцитов, обеспечивающих клеточно-опосредованный иммунитет. Другая популяция - В-лимфоциты - ответственна за формирование антител, обеспечивающих гуморальный иммунитет. Реактивы: мерные колбы объемом 25 мл; предметные стекла; рН-метр; микроскоп с иммерсионной системой (90x15); краситель нейтральный прочный синий; КН2РО4 с молекулярной массой 136,1 г/моль; Na2H PO4 c молекулярной массой 177,9 г/моль; вода дистиллированная; ацетон; формалин; азур - II (0,25% водный раствор).
Определение бактерицидной активности сыворотки крови (БАСК). Метод основан на свойствах сыворотки крови оказывать бактерицидное и бактериостатическое действие на микроорганизмы (тест-культуру). Предлагаемый фотонефелометрический метод основан на учете изменения оптической плотности питательной среды при добавлении в нее сыворотки крови. Реактивы: бульон Хоттингера стандартного состава, суточная культура E.coli, посеянная на твердый агар; 0,85%-й раствор хлорида натрия, стерильный; фотоэлектроколориметр или спектрофотометр с кюветами, рабочая длина 10 мм; термостат с режимом температуры 37°С; пробирки бактериологические; дозатор полуавтоматический на 100 мкл; пипетки стеклянные градуированные на 1 мл и 10 мл; пробирки Флоринского.
Определение лизоцимной активности сыворотки крови (ЛАСК). В основу метода определения лизоцимной активности сыворотки крови животных положена способность лизоцима быстро лизировать эталонную культуру Micrococ Iyzodeiticus. Оценка лизоцимной активности проводится с помощью нефелометрии по изменению оптической плотности суспензии Micrococ Iyzodeiticus после добавления в нее сыворотки крови. Реактивы: суточная культура Micrococ Iyzodeiticus; 0,5%-й раствор хлорида натрия; рН-метр (ионометр); фотокалориметр или спектрофатометр с кюветами, рабочая длина 10 мм; пипетки стеклянные, градуированные на 1 мл и 10 мл.
Определение иммуноглобулинов с использованием автоматического иммунохимического анализатора VIDAS. Иммуноглобулины обнаруживаются в сыворотке крови животных в таких количествах: IgG - 7-20 гл, IgA - 0,7-5 гл; IgM - 0,5-2 гл.
Оценку роста и развития подопытных свинок определяли по четырем показателям: живой массе, среднесуточным приростам, длине туловища, обхвату груди за лопатками. Живую массу (кг) определяли через каждые 30 дней с начала опыта путем индивидуального взвешивания утром перед кормлением, длину туловища (см) измеряли от затылочного гребня до корня хвоста, обхват грудной клетки (см) измеряли за лопатками.
Цифровой материал подвергали математической обработке с использованием пакета прикладных программ Statistica 6.0.
Результаты исследований и их обсуждение. В результате проведённых исследований установлено, что в течение всего экспериментального периода применяемые дозы изучаемого препарата не оказали отрицательного действия на организм животных. Все поросята были активны, хорошо поедали корм и не отставали по приростам от животных контрольной группы. На протяжение всего экспериментального периода ни в одной из опытных групп гибели животных не отмечалось.
При проведении исследований основных показателей роста и развития поросят установлены межгрупповые различия по живой массе и среднесуточным приростам свинок, обусловленные применением иммуностимулятора, на основе белко-во-липополисахаридный комплекса. Результаты представлены в таблице 1.
Таблица 1 Исследования и средства дохирургического лечения
| Показатели | Контрольные группы | 1-опытная группа | 2-опытная группа |
|---|---|---|---|
| Количество голов при постановке на опыт | 90 | 30 | 30 |
| Количество голов в конце опыта | 88 | 30 | 30 |
| Сохранность, % | 97,77 | 100 | 100 |
| Среднесуточный прирост, г | 441,22±7,84 | 493,19±8,96 | 494,28±6,72 |
У животных, получавших препарат в возрасте 2-х месяцев, разница по живой массе относительно контрольной группы была выше и соответствовала: в первой опытной группе - 1,67±0,46 и во второй - 1,89±0,24 кг.
Среднесуточные приросты за весь период эксперимента у свинок первой группы превосходили приросты животных контрольной группы на 52,6 г и второй - на 53,1 г.
Длина туловища у свинок в двухмесячном возрасте в первой и второй группах была больше, чем у контрольных животных на 1,45 и 1,95 см, соответственно.
Исследования продуктивных качеств и сохранности поросят на 30-е сутки жизни (период доращивания) показали, что средняя масса одного поросенка в 1-й группе составила 6,37 кг, превысив этот показатель на 21-е сут на 17,3%. Во 2-й группе средняя масса одного поросенка была равна 6,42 кг (превышение к 21 суткам составило 19,1%).
В 3-й (контрольной) группе средняя масса одного поросенка на 30-е суткам составила 5,90 кг и превышала этот показатель к моменту окончания эксперимента на 18,0%.
Перед проведением опыта, а также, согласно графика, в процессе применения препарата были проведены биохимические исследования крови (табл. 2).
Из представленных в таблице данных видно, что исследуемый иммуномодулятор оказывает положительное влиянии на организм. Все изучаемые показатели были в пределах физиологической нормы для данной возрастной группы животных, но отмечалось незначительное повышение лейкоцитов в крови всех опытных групп.
Как известно, лейкоциты участвуют в защитных реакциях организма и помогают ему бороться с многообразными неблагоприятными факторами внешней и внутренней среды.
Повышение уровня лейкоцитов у поросят подопытных групп можно связать с реакцией организма поросят на введение иммуномодулятора, в состав которого входят белково-липополиса-харидный комплекс антигенов, полученный из лизата бактерий.
При введении иммуностимулятора увеличивается одновременно количество лейкоцитов, эритроцитов, содержание гемоглобина и общего белка, что свидетельствует об усилении в организме опытных животных обменных процессов. Все это в целом свидетельствует о том, что биологический препарат оказывает благотворное влияние на организм опытных свинок.
Содержание гемоглобина на протяжении исследуемого периода также имело некоторые колебания у поросят исследуемых групп (табл. 2). У животных 1-й группы к 21-м суткам уровень гемоглобина практически не изменился, у поросят контрольной группы была отмечена тенденция его снижения на 4,2%.
Таблица 2 Гематологические показатели поросят, получавших препарат
| Показатели | Дни исследований | |||
|---|---|---|---|---|
| 0 | 8 | 15 | 22 | |
| Лейкоциты (WBC) 109/л | 11,64±1,08 | 14,61±1,39 | 16,10±0,97 | 12,61±1,12 |
| Лимфоциты (LYM) 109/л | 7,29±0,67 | 10,29±1,01 | 13,4±0,69 | 9,66±1,03 |
| Моноциты (MON) 109/л | 0,06±0,01 | 0,07±0,01 | 0,10±0,04 | 0,12±0,02 |
| Нейтрофилы (NEU) 109/л | 4,24±0,27 | 4,25±0,33 | 3,75±0,28 | 2,77±0,31 |
| Лимфоциты % | 62,91±6,59 | 70,47±7,15 | 76,53±6,88 | 77,21±8,01 |
| Моноциты % | 0,50±0,06 | 0,55±0,07 | 0,74±0,11 | 0,84±0,17 |
| Нейтрофилы % | 36,61±7,07 | 29,12±9,11 | 22,82±5,74 | 21,24±6,58 |
| Эритроциты (RBC) 1012/л | 6,29±0,58 | 6,84±0,71 | 7,03±1,06 | 7,08±0,78 |
| Гемоглобин (HGB) ммоль/л | 5,73±0,79 | 6,5±0,68 | 6,14±0,97 | 6,16±0,82 |
| Гематокрит (HCT) % | 34,24±4,34 | 37,72±5,48 | 41,51±6,09 | 39,47±4,31 |
| Средний объем эритроцитов (MCV) fl | 54,11±3,97 | 56,56±4,08 | 59,11±6,12 | 56,32±5,12 |
| Среднее содержание гемоглобина в эритроците (MCH) fmol | 0,90±0,06 | 0,95±0,11 | 0,91±0,22 | 0,93±0,19 |
| Сред. концентрация гемоглобина в эритроцитах (MCHC) ммоль/л | 16,62±2,05 | 17,12±1,31 | 15,43±1,78 | 16,65±1,15 |
| Распределение эритроцитов по объему (RDWc) % | 23,91±2,28 | 23,84±3,07 | 21,83±2,15 | 21,64±1,99 |
| Относит, ширина распредел эритроц. по объему (RDWs) fl | 47,74±4,07 | 48,42±3,98 | 46,91±2,96 | 43,54±3,78 |
| Тромбоциты (PLT) 109/л | 753,21±14,18 | 483,62±12,32 | 526,43±14,02 | 457,41±15,04 |
| Средний объем тромбоцитов (MPV) fl | 9,1±1,08 | 8,7±1,08 | 9,5±1,08 | 8,9±1,08 |
| Тромбокрит (PCT) % | 0,68±0,04 | 0,42±0,02 | 0,51±0,09 | 0,62±0,10 |
| Распределение тромбоцитов по объему (PD. Wc) % | 40,93±6,17 | 39,65±5,98 | 41,43±6,15 | 41,12±5,24 |
| Относит. ширина распределения тромбоц. по объему (PDWs) fl | 16,62±1,63 | 16,12±2,13 | 17,84±2,56 | 16,72±2,07 |
Содержание гемоглобина к 21-м суткам соответствовало физиологической норме только у поросят 1-й и 2-й групп. В контрольной группе его уровень был снижен от нормы на 5,3%. Отмеченное уменьшение содержания гемоглобина очевидно связано с наличием незначительной алиментарной анемии у поросят.
Проведенное в отношении поросят гематологическое исследование позволило выявить, что лишь у экспериментальных поросят отмечено наличие достоверных изменений в группах. В сопоставлении с контролем уровень красной крови у относившегося ко 2 - й группе молодняка был более высоким. Поросята, получавшие препарат, характеризовались более высоким уровнем гемоглобина.
Установлено на основе лейкограммы, что у поросят в 1- й и 2- й группах достоверное существенное увеличение в сопоставлении с контролем числа эозинофилов. Также установлено, что лимфоциты и нейтрофилы возросли у всех поросят, входивших в экспериментальные группы.
Так после применения поросятам подопытных групп препарата произошло повышение в сыворотке крови белка - на 21,9 и 21,3%, соответственно, по сравнению с контролем при р<0,01.
Кроме того, во второй опытной группе после применения исследуемого иммуномодулятора активность аланинаминотрансферазы и аспартатаминотрансферазы уменьшилась на 31,4 и 28,7% по сравнению с контролем.
Отмеченное у поросят контрольных групп снижение активности аланинаминотрансферазы и аспартатаминотрансферазы к 21-м суткам характеризует наступление у животных к этому времени второго физиологического иммунодефицита, при котором уменьшается количество клеток, секретирующих ферменты, что характерно для интоксикации организма и возможных нарушениях функции желчного пузыря.
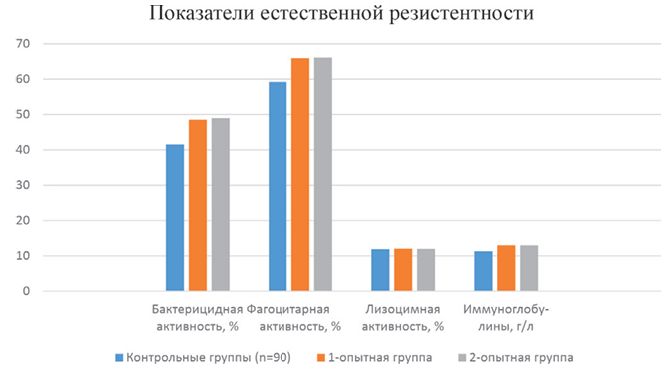
Естественную резистентность организма поросят оценивали по бактерицидной и лизоцимной активности сыворотки крови, фагоцитарной активности лейкоцитов и количеству иммуноглобулинов.

Рис. 1. Показатели естественной резистентности поросят, получавших препарат
При изучении показателей неспецифической резистентности во всех опытных группах установлено повышение показателей клеточного иммунитета. У животных 1-ой подопытной группы фагоцитарная активность возросла на 7,08%, фагоцитарное число на 0,66 микр./лейк. (Р<0,05), во второй группе эти показатели составили - 6,84, 0,61 (Р<0,05); в контрольной группе - 5,84; 0,51, соответственно.
Гуморальные факторы естественной резистентности, также увеличились в группах, где задавали препарат. Бактерицидная и лизоцимная активность сыворотки крови с повысились в первой группе на 11,7 и 12,13; во второй - на 10,76 и 10,5; в контрольной группе на 7,48% (Р<0,05).
К концу эксперимента в результате применения препарата бактерицидная активность сыворотки крови в опытных группах в среднем возросла 15,4%. Фагоцитарная активность лейкоцитов повысилась в этих группах на 11,0-11,5%. Во всех случаях разница с контролем подтвердилась статистически (рисунок 1).
В связи с тем, что уровень глобулинов увеличился, у входивших во вторую и первую группы поросят к возрасту окончания эксперимента показатель по общему белку был выше в сопоставлении с контролем. Альбуминовая фракция обеспечила рост количества общего белка при применении препарата.
Как известно, содержание в— и Y—глобулинов в крови животных имеет важное значение для защиты организма от внешнего воздействия. Фракции Y—глобулинов содержат основную массу антител (иммуноглобулинов), которые обеспечивают гуморальную защиту организма. Следовательно, изучаемый препарат повышал иммунный статус животных
Таким образом, показатели естественной резистентности свинок опытных групп, получавших иммуномодулятор, были значительно выше по сравнению с контрольными группами.
В крови определяли содержание Т- и В-лимфоцитов. Т-лимфоциты определяли методом спонтанного розеткообразования с эритроцитами барана, В-лимфоциты определяли в реакции розет-кообразования с эритроцитами барана, обработанными антителами с комплиментом. Данные отображены в таблице 3.
Таблица 3 Динамика содержания Т- и В-лимфоцитов в крови поросят, получавших препарат
| Дни исследований | Количество лимфоцитов х 109/л | Т-лимфоциты, ЕРОК | В-лимфоциты, ЕАС-РОК | ||
|---|---|---|---|---|---|
| 109/л | % | 109/л | % | ||
| 0 | 11,64±1,08 | 5,11±0,16 | 22,57±0,98 | 3,44±0,35 | 15,14±0,57 |
| 8 | 14,61±1,39 | 5,39±0,22 | 31,33±1,27 | 3,94±0,22 | 26,51±0,98 |
| 15 | 16,10±0,97 | 5,61±0,42 | 39,99±1,54 | 4,13±0,45 | 36,92±1,87 |
| 22 | 12,61±1,12 | 5,52±0,64 | 39,42±1,38 | 4,02±0,29 | 35,68±1,55 |
Полученные данные свидетельствуют о том, что общее количество Т- и В-лимфоцитов у поросят подвержено изменениям. Наименьшее количество числа лимфоцитов было у поросят контрольных групп, максимальное значение наблюдалось у поросят в возрасте 60 дней, получавших препарат. По анализу общего количества лимфоцитов в крови поросят прослеживается тенденция к увеличению абсолютного числа лимфоцитов по мере увеличения дачи препарата. Рассматривая отделано динамику Т- и В-лимфоцитов следует отметить, что в первые дни эксперимента поросят основную массу среди лимфоцитов составляли Т-клетки. По мере взросления животных идет увеличение как абсолютного числа В-лимфоцитов, так и количества розеткообразующих В-лим-фоцитов. В динамике общего количества лимфоцитов в крови поросят прослеживается тенденция к увеличению абсолютного числа лимфоцитов по мере дачи препарата.
Иммуноглобулины - антитела, обеспечивающие гуморальный иммунитет. Снижение отмечается при различных иммунодефицитах по В звену, нарушении обмена веществ, стрессах, авитаминозах (особенно витамин А). Повышение - при применении иммуномодуляторов, повышении антигенной нагрузки.
На протяжении эксперимента при введении препарата сывороточный иммуноглобулин А значительно вырос (на 7,6%), также отмечен рост числа IgG и IgM.
На 22-е сутки после начала дачи препарата отмечен достоверный рост IgG в сопоставлении с контролем у животных 1- й и 2-й групп. При этом до конца эксперимента значение возрастало у животных, входивших в подопытные группы количество IgM (рисунок 2).
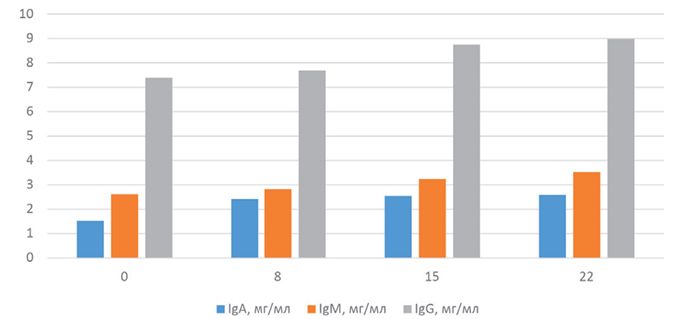
Рис. 2. Динамика содержания иммуноглобулинов в крови поросят, получавших препарат
На протяжении эксперимента при введении исследуемого иммуномодулятора иммуноглобулин А вырос вдвое. Также отмечен существенный рост числа IgG, IgM. Получившие препарат животные продемонстрировали рост IgG с последующим увеличением, а также рост на более чем семьдесят процентов IgM и IgA.
Таким образом, исследуемый биостимулятор способствовал повышению клеточных факторов защиты организма. Применение биостимулятора повысило уровень гуморальных факторов естественной резистентности. Кроме, того использование препарата способствует более интенсивному синтезу мышечной ткани, о чем свидетельствует увеличение массы и длины туши.
Заключение. На основе проведённых исследований можно заключить, что 30-суточное скармливание исследуемого иммуномодулятора, содержащего лизаты пробиотических бактерий, поросятам-отъёмышам не оказывает отрицательного влияния на организм животных, биохимические показатели крови и не вызывает макроскопических изменений со стороны наружных органов, что позволяет длительно применять препарат животным без ущерба для их здоровья. На 30-й день после введения исследуемого иммуностимулятора у свиней достоверно увеличиваются гематологические, биохимические и иммунологические показатели. Во всех опытных группах поросят выражено увеличение естественной резистентности, на что указывает повышение фагоцитарной активности нейтрофилов и лизоцимной активности сыворотки крови. Применение препарата способствует активации работы иммунной системы свиней. На протяжении эксперимента при введении исследуемого иммуномодулятора иммуноглобулин А вырос вдвое. Также отмечен существенный рост числа IgG, IgM. Получившие препарат животные продемонстрировали рост IgG с последующим увеличением, а также рост на более чем семьдесят процентов IgM и IgA. Мы рекомендуем применять препарат поросятам с 10 дня жизни в любой период в смеси с кормом в дозе 200 - 600 г на 1 тонну корма в течение срока от 7 до 40 дней для повышения продуктивности и естественной резистентности.
Список литературы:
1. Федотов С.В., Максимов В.И., Корязова М.А. Репродуктивные особенности свиней крупной белой породы. Ветеринария, зоотехния и биотехнология. 2021; (4): 41-46.
2. Латынина Е.С., Дюльгер Г.П., Кашковская Л.М. Терапия синдрома послеродовой дисгалактии свиноматок препаратом на основе цефтиофу-ра. Вестник КрасГАУ. 2021; (12): 227-231.
3. Хаитов Р.М. Иммуномодуляторы: мифы и реальность. Иммунология. 2020; (41 (2): 101-106.
4. Хаитов Р.М., Атауллаханов Р.И., Шульженко А.Е. Иммунотерапия: руководство для врачей. ГЭОТАР-Медиа. 2018: 786 с.
5. Востроилова Г.А., Хохлова Н.А., Канторович Ю.А., Корчагина А.А. Изучение токсичности аминоселеферона в остром и хроническом опыте. Ученые записки УО ВГАВМ. 2018; (54 (4).
6. Трухачев В.И., Юлдашбаев Ю.А., Свинарев И.Ю. Современное состояние и перспективы развития животноводства России и стран СНГ. 2022: 337 с.
7. Nifontova E.A. et al. Complex Supply Modeling in Meat Industry: Quantitative Methods and Digital Solutions. Springer. 2023: 115-120.
8. Semenov V.G. et al. Physiological state and reproductive qualities of sows when using probiotic preparations A2 and Immunoflor. 012023.
9. Nikonova A.A. et al. TLR4 Agonist Immunomax Affects the Phenotype of Mouse Lung Macrophages during Respiratory Syncytial Virus Infection. Acta Naturae. 2018; (10 (4): 95-99.
10. Шапошников И.Т., Коцарев В.Н., Скориков В.Н. Эффективность применения аминоселеферона-б при иммунодефицитном состоянии у высокопродуктивных коров в условиях техногенной нагрузки на окружающую среду. Вестник РУДН. Серия: Агрономия и животноводство. 2022.
11. Fedotov S. et al. Reproductive features of PRRS-convalescent large white pigs after porcine reproductive and respiratory syndrome. UESF. Web of Conference. 2023.
Сведения об авторах:
Федотов Сергей Васильевич, доктор ветеринарных наук, профессор, заведующий кафедры ветеринарной медицины ФГБОУ ВО «Российский государственный аграрный университет - МСХА имени К.А. Тимирязева»; 127434, г. Москва, ул. Тимирязевская, 49; e-mail: serfv@mail.ru.
Латынина Евгения Сергеевна, кандидат ветеринарных наук, доцент кафедры ветеринарной медицины ФГБОУ ВО «Российский государственный аграрный университет - МСХА имени К.А. Тимирязева»; 127434, г. Москва, ул. Тимирязевская, 49.
Садыхов Эдуард Фамилович, аспирант кафедры ветеринарной медицины ФГБОУ ВО «Российский государственный аграрный университет -МСХА имени К.А. Тимирязева»; 127434, г. Москва, ул. Тимирязевская, 49.
Ответственный за переписку с редакцией: Алиев Аюб Юсупович, доктор ветеринарных наук, директор Прикаспийского зонального научно-исследовательского ветеринарного института - филиала ФГБНУ «ФАНЦ РД»; 367000, Республика Дагестан, г. Махачкала, ул. Дахадае-ва, 88; тел.: 8-928-5715784; e-mail: alievayb1@mail.ru.
Заявленный вклад авторов:
Алиев А.Ю.: разработка концепции, курирование данных, написание рукописи - рецензирование и редактирование;
Федотов С.В.: разработка методологии, курирование данных, предоставление ресурсов, написание рукописи - рецензирование и редактирование;
Латынина Е.С.: проведение исследования, формальный анализ, визуализация, написание черновика рукописи;
Садыхов Э.Ф.: проведение исследования, валидация, визуализация, написание черновика рукописи.
Конфликт авторов: авторы заявляют об отсутствии конфликта интересов.
http://www.vetkuban.com/num3_202505.html