|
||||

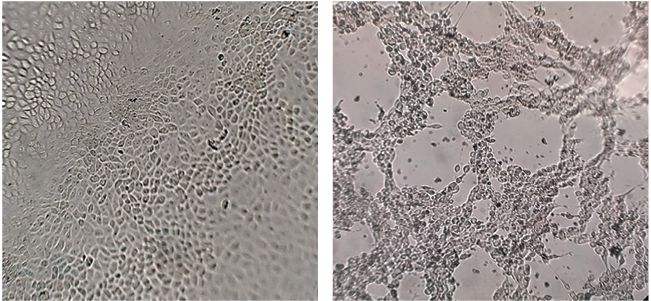
Очистка антигенов штамма «ТК-А (ВИЭВ)-В2» бычьего альфагерпесвируса биотипа 1УДК 619:578.825.15:578.74:577.112.083 Оригинальное эмпирическое исследование Мухаммадиев Риш.С., Каримуллина И.Г., Яруллин А.И., Сорокина Д.А., Хаертынов К.С., Галеева А.Г., Мухаммадиев Рин.С., Хафизова А.М. Аннотация. Инфекции, вызываемые альфагерпесвирусом типа 1 крупного рогатого скота, до сих пор остаются существенной проблемой интенсивного скотоводства. В этом плане эффективность противоэпизоотических мероприятий обусловлена своевременным выявлением инфицированного животного, правильным выбором средств и подходов профилактики заболеваний. Настоящая работа посвящена очистке антигенов штамма «ТК-А (ВИЭВ)-В2» альфагерпесвируса биотипа 1 крупного рогатого скота. Оптимальная схема выделения и очистки антигенов герпесвируса включала дезинтеграцию вируссодержащей культуральной жидкости ультразвуком, фракционирование реагентом полиэтиленгликолем 6000 и очистку с помощью ступенчатого градиента плотности сахарозы методом ультрацентрифугирования. В результате последнего этапа очистки нами получено семь антигенных препаратов. Наибольшую серологическую активность, согласно данным непрямого варианта иммуноферментного анализа, проявляли антигенные препараты № 1.1.2, № 4.1 и № 5: значения ОП450 при разведении положительной сыворотки 1:200 составили, соответственно, 1,586±0,036 ОЕ (К+КРС/К-КРС = 5,27), 1,081±0,023 ОЕ (К+КРС/К-КРС = 8,72) и 1,236±0,029 ОЕ (К+КРС/К-КРС = 4,61). Перспективным являлся препарат № 4.1, который, по результатам электрофореза и иммуноблотинга, содержал мажорные участки полипептидов с молекулярной массой от 50 до 100 кДа, обладающие антигенными свойствами. Титр антител, установленный в иммуноферментном анализе, на 14 сутки после иммунизации антигенными препаратами № 1.1.2, № 4.1 и № 5 составил в сыворотке крови кроликов 1:200, 1:400 и 1:400, соответственно. Дальнейшие исследования открывают перспективы применения полученных нами антигенов альфагерпе-свируса в качестве иммунизирующих агентов для получения препаратов иммуноглобулинов с высокой активностью и компонентов тест-системы иммуноферментного анализа для серологической диагностики инфекционного ринотрахеита крупного рогатого скота. Ключевые слова: бычий альфагерпесвирус биотипа 1, очистка антигенов, фракционирование полиэтиленгликолем, ступенчатый градиент плотности сахарозы, тест-система иммуноферментного анализа, диагностика, инфекционный ринотрахеит, скотоводство. В настоящее время широкое распространение, эпи- зоотологическое и экономическое значение имеет бычий альфагерпесвирус биотипа 1 (BoAHV1 - Bovine Alphaherpesvirus type 1), включающий два основных подтипа (1 и 2) [14, 24]. К подтипу 1 BoAHV1 относят штаммы, вызывающие у крупного рогатого скота поражения респираторного тракта (инфекционный ринотрахеит (далее, ИРТ)), к подтипу 2 -штаммы, приводящие к поражению гениталий (инфекционный вульвовагинит/баланопостит) [8, 17]. Указанные подтипы альфа-герпесвируса не отличаются по биологическим и серологическим свойствам, их различие, как правило, устанавливают молекулярно-генетическим методом [8, 15]. Нарушения, возникающие вследствие воздействия BoAHV1 на иммунную систему крупного рогатого скота, могут приводить к вторичным бактериальным инфекциям [16, 25]. BoAHV-1, наряду с другими респираторными вирусами, такими как вирус вирусной диареи, респираторно-синцитиальный вирус, вирус парагриппа типа 3 и патогенными бактериями способен вызывать комплекс респираторных заболеваний крупного рогатого скота, наносящий значительный экономический ущерб интенсивному скотоводству и ухудшающий положение в области глобальной продовольственной безопасности [3, 22]. Следует отметить, что к настоящему времени в ряде стран Европы, а именно Финляндии, Швеции, Норвегии, Дании, Австрии и Швейцарии, вакцинопрофилактика крупного рогатого скота в животноводческих фермах позволила ликвидировать вызываемый подтипом 1 BoAHV1 ИРТ [13, 18]. BoAHV1 является ДНК-содержащим вирусом, который относится к семейству Herpesviridae, подсемейству Alphaherpesvirinae и роду Varicellovirus [20]. Вирусный геном бычьего альфагерпес-вируса кодирует более 70 различных белков и в своем составе имеет уникальные последовательности (сегменты) - длинная (long, UL) и короткая (short, US), ограниченные инвертированными повторами [1, 18]. Уникальный длинный сегмент генома BoAHV1 кодирует гликопротеины gB (UL27, молекулярная масса 130 кДа), gC (UL44, молекулярная масса 91 кДа), gH (UL22, молекулярная масса 108 кДа), gL (UL1, молекулярная масса 17 кДа), gK (UL53, молекулярная масса 35 кДа) и gM (UL10, молекулярная масса 43 кДа), в то время как уникальный короткий сегмент - gG (US4, молекулярная масса 47 кДа), gD (US6, молекулярная масса 71 кДа), gI (US6, молекулярная масса 40 кДа), и gE (US8, молекулярная масса 92 кДа) [14]. Установлено, что указанные структурные гликопротеины способны участвовать в процессах патогенеза заболеваний и стимуляции иммунного ответа [11, 14]. При этом основным антигеном с протективным потенциалом является белок gD [11], открывающий возможности его применения в качестве компонента различных типов вакцин и тест-системы иммуноферментного анализа (далее, ИФА) для диагностики BoAHVl-инфекции крупного рогатого скота. Целью настоящей работы была очистка антигенов штамма «ТК-А (ВИЭВ)-В2» бычьего альфагерпесвируса биотипа 1. Материалы и методы исследований. Вирусный штамм «ТК-А (ВИЭВ)-В2» BoAHV1 получен из отдела Государственной коллекции микроорганизмов (Федеральный центр токсикологической, радиационной и биологической безопасности; ФГБНУ «ФЦТРБ-ВНИВИ», Россия). Клетки почки теленка MDBK (ФКП «Щелковский биокомбинат, Россия) культивировали в смешанной питательной (поддерживающей) среде, содержащей 0,5% ГЛА, Игла MEM и 199 (в соотношении 1:1:1) с 10% эмбриональной сывороткой крупного рогатого скота (Capricorn Scientific, Германия), 2 мМ L-глутамином (БиолоТ, Россия) и гентамицином (Corning Inc., США) 40 мкг/мл, при (37±1)°С и 5% СО2 [9]. Накопление биомассы штамма альфагерпесвируса проводили способом культивирования клеток MDBK в роллерных бутылях на роллерной установке [21]. Для этого клетки вышеуказанной культуры выращивали при коэффициенте заполнения бутылей (далее, КЗБ) 0,18 ед., скорости вращения бутылей (далее, СВБ) от 10 до 11 об/ч, температуре (37±1)°С в течение 48 ч. После удаления ростовой среды и тщательного промывания раствором Хенкса (Servicebio Technology, Бельгия) монослоя клеток вносили к последней вирусный материал в концентрации (0,4±0,1) ТЦД50/мл (50% тканевая цитопатическая доза) на клетку. Бутыли инкубировали в течение 50 мин для адсорбции вируса и добавляли поддерживающую среду. Зараженную герпесвирусом культуру клеток культивировали в тех же условиях (КЗБ - 0,18 ед., СВБ -10-11 об/ч, (37±1)°С). Сбор вируссодержащей культуральной жидкости (далее, ВКЖ) осуществляли через 36 ч инкубации. Для определения инфекционной активности альфагерпесви-руса проводили титрование ВКЖ последнего в культуре клеток MDBK [9]. Анализ проводили в особых 96-луночных культуральных панелях (Techno Plastic Products, Швейцария). Для этого, в лунках панели 30 мкл ВКЖ последовательно десятикратно разводили поддерживающей средой. После чего разведения ВСЖ переносили в лунки коммерческой панели с монослоем клеток. Инкубацию инфицированных вирусом MDBK осуществляли при (37±1)°С в инкубаторе Binder CB210 (Binder, Германия) с 5% СО2 до появления цитопатического эффекта (далее, ЦПЭ), интенсивность которого оценивали путем микроскопирования клеток ежедневно. Расчёт титра герпесвируса проводили согласно методу, описанному в работе [16]. Контролем служили неинфицирован-ные вирусом клетки, выращенные в указанных выше условиях. Выделение антигенов бычьего альфагерпесвируса осуществляли методом дезинтеграции ВКЖ ультразвуком [7] при следующих режимах: продолжительность озвучивания - 120 с, интервал между импульсами - 60 с, частота колебаний - 22 кГц, температура - (4±1) °С. С использованием центрифуги Eppendorf 5804R (Eppendorf, Германия) осаждали дебрис клеток при 3,5 тыс. об/ мин и (4±1)°С в течение 30 мин. По окончании процесса отбирали супернатант и использовали для дальнейших этапов очистки. Предварительную очистку антигенов из полученного на предыдущем этапе супернатанта проводили осаждением белков альфагерпесвируса реагентом полиэтиленгликолем (далее, ПЭГ) 6000 (PanReac AppliChem, Германия, Испания) [5]. Для этого к супернатанту вносили ПЭГ 6000 и NaCl до конечной концентрации, соответственно, 29,0 и 80,0 г/л и инкубацию вели при (4±1)°С в течение 12 ч. Концентрирование белков герпесвируса осуществляли с помощью вышеуказанной центрифуги при 8 тыс. об/мин в течение 60 мин. Супернатант удаляли и осадок ресуспендиро-вали в наименьшем объеме 0,05 М фосфатно-солевого буфера (pH 7,3). Очистку антигенов штамма альфагерпесвируса в градиенте плотности сахарозы проводили согласно протоколу [23], оптимизированного для применяемых нами условий ультрацентрифугирования (далее, УЦФ). Для формирования градиента плотности сахарозы в шесть 13-миллилитровых ультрацентрифужных пробирки (Beckman Coulter, США) последовательно вносили равные объемы (по 3 мл) раствора сахарозы (Acros Organics, Бельгия) 60, 40 и 30%, соответственно. Суспензию очищенных ПЭГ-осаждением антигенов (4 мл) доводили до объема 15 мл 0,05 М фосфатно-солевым буфером (pH 7,3) и наслаивали поверх градиента (по 2,5 мл на пробирку). УЦФ осуществляли с помощью центрифуги Optima ХЕ-100 (Beckman Coulter, США) при 30 тыс. g и (4±1)°С в течение 2,5 ч. По окончании процесса с ультрацентрифужных пробирок отбирали фракции и подвергали анализу с помощью электрофореза в 12,5% полиакриламидном геле в денатурирующих условиях (SDS-PAGE) [19] и иммуноблотинга с использованием сывороток кпупного рогатого скота для установления локализации полипептидов и их серологической активности [23]. На каждой стадии очистки антигена альфагерпесвируса устанавливали концентрацию белка в полученных образцах фракций методом спектрофотометрии [2]. Образцы белковых фракций (препаратов) применяли с целью иммунизации ими животных для возможности получения препаратов иммуноглобулинов и в качестве антигена-компонента ИФА. Для иммунизации животных очищенными препаратами антигена альфагерпесвируса использовали 12 кроликов породы Шиншилла (масса 2,8-3,0 кг) [4], полученных из питомника ФГБНУ «ФЦТРБ-ВНИВИ» (г. Казань, Россия). Животным группы 1 (n = 3), 2 (n = 3) и 3 (n = 3) вводили внутрикожно в пяти точках, с двух сторон в области спины антигенные препараты № 1.1.2, № 4.1 и № 5, соответственно, в смеси с полным адъювантом Фрейнда в концентрации 100 мкг/гол. Контролем служила группу 4 (n = 3), где кроликам вводили буферный раствор. Забор крови животных для получения сывороток осуществляли до и после введения антигенных препаратов: через 14 суток после иммунизации. Сыворотки получали путем их отделения от клеточных элементов центрифугированием крови при 3 тыс. об/мин в течение 15 мин. Ежедневно в течение всего периода исследования оценивали выживаемость животных в процентах. Исследования с кроликами проводились строго с соблюдением требований ГОСТ 332152014 и Директивы ЕС 2010/63/EU. Анализ антител к антигенным препаратам альфагерпесви-руса проводили в сыворотках крови кроликов методом непрямого ИФА [6]. Для этого 96-луночные плоскодонные планшеты (Sovtech, Россия) сенсибилизировали очищенными антигенными препаратами № 1.1.2, № 4.1 и № 5 с концентрацией 5 мкг/мл в объеме 100 мкл/лунка в течение 16 ч при (4±1)°С. Полученные сыворотки вносили в объеме 100 мкл/лунка в разведении 1:200 и выдерживали планшет в течение 60 мин при (37±1)°С. Раствор антител кролика к IgG, IgA и IgM, меченых пероксидазой хрена (Имтек, Россия), добавляли в объеме 100 мкл/лунка в разведении 1:10000 и инкубацию вели в условиях, описанных выше. Иммунную реакцию проявляли внесением свежеприготовленного субстратного (хромогенного) раствора на основе 3.3’.5.5’-тетра-метилбензидина в объеме 100 мкл/лунка, останавливали - 0,5 М раствора H2SO4 в объеме 50 мкл/лунка. Измерение оптической плотности (ОП450) окрашенного продукта осуществляли с применением фотометра Bio-Rad 680 (Bio-Rad, США) при длине волны 450 нм. Титр антител рассчитывали по величине разведения сыворотки при условии, что значение ОП450 исследуемого образца в два раза превышает таковое контрольного образца. Статистический анализ полученных результатов проводили в программе Statistica 6.0 (Stat Soft, США) и MS Excel 2016 (Microsoft, США), используя критерий Стьюдента [12]. Значимыми считали данные показателей с уровнем достоверности p<0,05. Результаты исследований и их обсуждение. Для экспериментов по очистке антигенов вирусного штамма «ТК-А (ВИЭВ)-В2» нами наработана биомасса альфагерпесвируса способом культивирования клеток MDBK в роллерных бутылях на роллерной установке. В отличие от традиционного подхода к выращиванию вирусов в монослое культуры клеток с применением стеклянных матрасов указанный выше способ имеет ряд преимуществ: экономия питательной среды, возможность контроля процесса культивирования и получения высоких значений титра инфекционной активности вируса [9, 21]. Одним из недостатков культивирования в роллерных системах является отсутствие возможности наблюдения трансформации клеток культуры после их инфицирования вирусом [10]. На рисунке 1 показаны изменения морфологии инфицированных штаммом «ТК-А (ВИЭВ)-В2» BoAHV1 клеток MDBK, которые выращены в стационарных условиях.
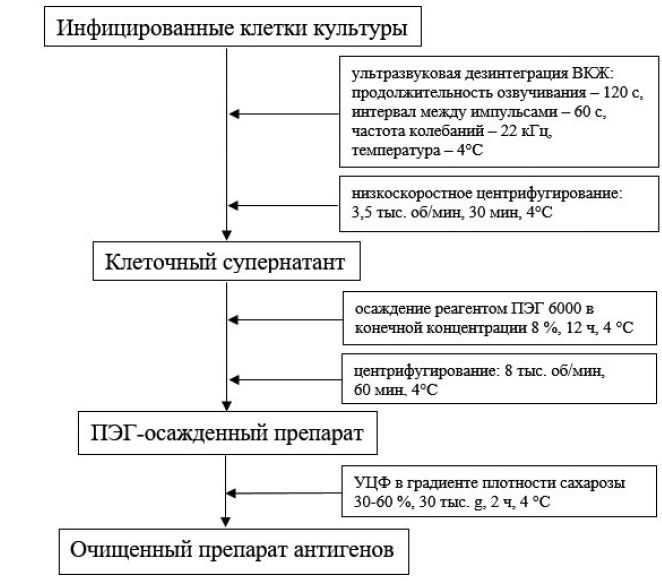
Рис. 1. Изменения морфологии клеток MDBK после инфицирования штаммом «ТК-А (ВИЭВ)-В2» BoAHVl: слева - контрольные клетки, справа - клетки через 48 ч после инфицирования (увеличение*100) Показано, что при роллерном культивировании вирусный штамм «ТК-А (ВИЭВ)-В2» накапливался в клетках MDBK до титров (8,25±0,05) lg ТЦД50/см3. В нашей более ранней работе [21] установлено, что инфекционная активность штамма «ТК-А (ВИЭ-В)-В2» при выращивании в указанных условиях была на 1,29 lg ТЦД50/см3 выше, чем при использовании метода культивирования герпесвируса в монослое культуры клеток MDBK с применением стеклянных матрасов. Методы очистки белковых антигенов вирусов характеризуются отличительными особенностями, которые обусловлены неустойчивостью молекулы белка и утратой необходимых свойств в результате воздействия различных факторов внешней среды [23]. В связи с этим для получения очищенных антигенных препаратов используют комбинации методов осаждения и разделения, позволяющие снижать количество стадии очистки антигенов [6, 23]. В наших исследованиях оптимальная схема очистки антигенов штамма «ТК-А (ВИЭВ)-В2» BoAHV1 включала 3 основных этапа: ультразвуковое разрушение ВКЖ и освобождение от клеточных фрагментов низкоскоростным центрифугированием; концентрирование белков клеточного супернатанта реагентом ПЭГ 6000 и получение осадка центрифугированием; очистка суспензии ПЭГ-осажденных антигенов с помощью ступенчатого градиента плотности сахарозы методом УЦФ (рисунок 2).
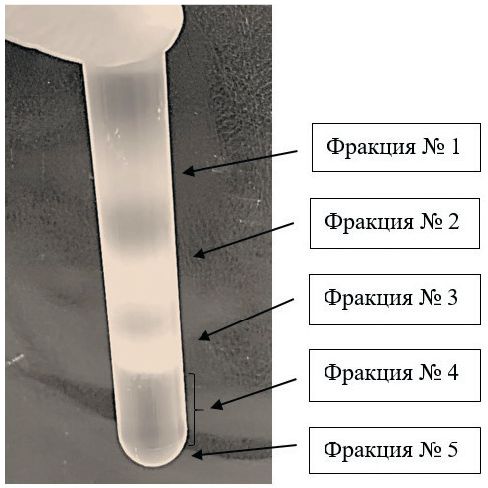
Рис. 2. Схема очистки препарата антигенов штамма «ТК-А (ВИЭВ)-В2» BoAHV1 Предварительную очистку антигена штамма «ТК-А (ВИЭВ)-В2» проводили осаждением белков альфагерпесвируса из клеточного супернатанта, полученного обработкой ультразвуком вируссодер-жащей биомассы, реагентом ПЭГ. Содержание белка в ПЭГ-осаж-денном образце составило 58,1 % от концентрации белка клеточного супернатанта (табл. 1). Полученный осадок антигена без дополнительных стадий (диализа) переводили в буферный раствор и применяли на следующем этапе очистки. Согласно литературным данным, использование указанного осадителя позволяет снизить концентрацию белковых примесей в биологическом образце [5]. На следующем этапе нами применен метод фракционирования препарата после очистки ПЭГ в градиенте плотности сахарозы 30-60 %, позволяющий в одном раунде проводить очистку существенно большего количества вирусных частиц и белков [5]. В результате исследований удалось получить пять основных антигенных фракций (рисунок 3), которые дополнительно подвергались УЦФ для эффективной их очистки.
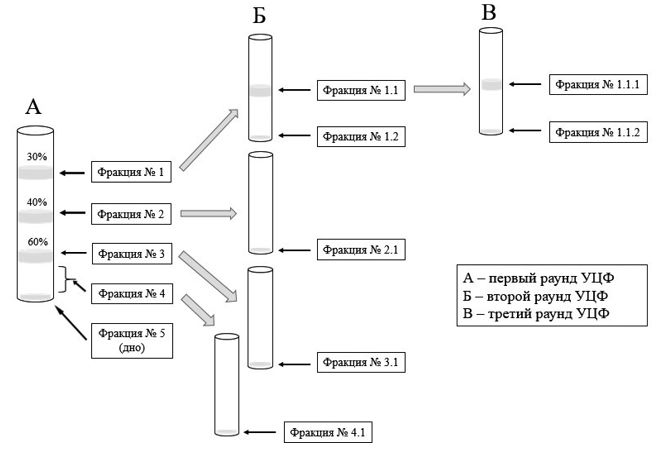
Рис. 3. Результаты первого раунда фракционирования ПЭГ-очищен-ного препарата штамма «ТК-А (ВИЭВ)-В2» герпесвируса в ступенчатом градиенте плотности сахарозы Предложенный подход позволил нам из материала штамма герпесвируса получить семь белковых фракций (рисунок 4).
Рис. 4. Схема фракционирования ПЭГ-очищенного препарата штамма «ТК-А (ВИЭВ)-В2» BoAHV1 в ступенчатом градиенте плотности сахарозы Полученные антигенные фракции (препараты) анализировали на степень чистоты (результаты не показаны) и содержание белка (табл. 1). Наибольшая концентрация общего белка установлена в антигенном препарате № 2.1 (156,8 ± 3,6 мг), наименьшее - препарате № 5 (7,4 ± 0,1 мг). Потеря содержания белка на данном этапе составила 53,1%, что свидетельствует о необходимости дополнительной оптимизации процесса фракционирования ПЭГ-очищенного препарата бычьего альфагерпесвируса. Для установления активности и специфичности препаратов антигенов штамма «ТК-А (ВИЭВ)-В2» проводили иммуноблот анализ с использованием сывороток крупного рогатого скота (рисунок 5).
Рис. 5. Результаты вестерн-блота очищенных антигенных препаратов штамма «ТК-А (ВИЭВ)-В2» BoAHV1 с положительной (слева) и отрицательной (справа) сывороткой к антигену вируса ИРТ крупного рогатого скота; треки: 1 - препарат № 1.1.1; 2 - препарат № 1.1.2; 3 - препарат № 1.2; 4 - препарат № 2.1; 5 - препарат № 3.1; 6 - препарат № 4.1; 7 - препарат № 5; М - белки-маркеры Установлено, что существенная часть очищенного материала распределялась в области с молекулярной массой от 50 до 100 кДа. Полученные нами антигенные препараты с указанной молекулярной массой, скорее всего, относятся к гликопротеинам оболочки gC, gD и gE, участвующие в прикреплении/проникновении герпесвируса и способные индуцировать протективный иммунитет [11, 14]. Активность и специфичность препаратов антигенов альфагерпе-свируса подтверждали с помощью непрямого варианта ИФА (табл. 1). Таблица 1 Активность и специфичность антигенных препаратов штамма «ТК-А (ВИЭВ)-В2» BoAHV1
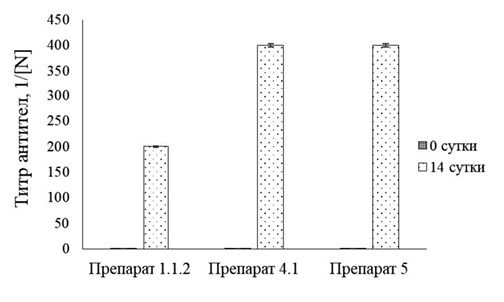
*При постановке ИФА антигенные препараты разведены 0,05 М карбонатно-бикарбонатным буферным раствором (рН 9,6) в 2000 раз, сыворотки - 0,05 М фосфатно-солевым буферным раствором (pH 7,3) с твином 20 в 200 раз Результаты исследований показали, что наибольшую серологическую активность проявили антигенные препараты № 1.1.2, № 4.1 и № 5. При этом значения ОП450 при разведении положительной сыворотки 1:200 составили, соответственно, 1,586±0,036 ОЕ (К+КРС/К-КРС = 5,27), 1,081±0,023 ОЕ (К+КРС/К-КРС = 8,72) и 1,236±0,029 ОЕ (К+КРС/ К-КРС = 4,61). Учитывая результаты вестерн-блота и ИФА нами для дальнейших исследований были отобраны антигенные препараты № 1.1.2, № 4.1 и № 5, среди которых наиболее перспективным являлся препарат № 4.1. В настоящей работе проведена оценка возможности применения очищенных препаратов антигена штамма «ТК-А (ВИЭВ)-В2» BoAHV1 в качестве иммунизирующих агентов для возможности получения препаратов иммуноглобулинов (рисунок 6).
Рис. 6. Накопление специфических антител в сыворотке крови кроликов после иммунизации антигенными препаратами штамма «ТК-А (ВИЭВ)-В2» BoAHV1 Титр антител в непрямом варианте ИФА на 14 сутки после иммунизации антигенными препаратами № 1.1.2, № 4.1 и № 5 штамма «ТК-А (ВИЭВ)-В2» составил в сыворотке крови кроликов 1:200, 1:400 и 1:400, соответственно. Однократное внутрикожное введение антигенных препаратов в концентрации 100 мкг/гол не вызывало гибели кроликов породы Шиншилла в течение эксперимента (табл. 2). Таблица 2 Результаты гибели кроликов породы Шиншилла после введения антигенных препаратов штамма «ТК-А (ВИЭВ)-В2» BoAHV1
Анализ полученных результатов свидетельствует об антигенной специфичности очищенных протеинов вирусного штамма, использованного нами в исследовании, и возможности применения их в качестве иммунизирующих агентов для дальнейшего получения препаратов иммуноглобулинов. Предложенный способ выделения и очистки антигенов штамма «ТК-А (ВИЭВ)-В2» является важным при создании руководств по проведению экспериментальных работ в области наработки и очистки гликопротеинов BoAHV1 и может быть применен для получения антигенов вирусов - возбудителей особо опасных инфекций сельскохозяйственных животных. Заключение. В результате трехстадийной очистки, включающей дезинтеграцию ВКЖ ультразвуком, фракционирование реагентом ПЭГ 6000, очистку с помощью ступенчатого градиента плотности сахарозы методом УЦФ были получены препараты антигенов герпесвирусного штамма «ТК-А (ВИЭВ)-В2». Дальнейшие исследования открывают перспективы применения полученных нами антигенных препаратов в качестве компонентов тест-системы ИФА для серологической диагностики BoAHV1-инфекции. Список литературы: 1. Альфа-герпесвирусы: современный взгляд на структуру/ Е.В. Маркелова, С.В. Кныш, Т.А. Невежкина, Е.В. Байбарина// ТМЖ. 2018. № 4 (74). C. 5-9. DOI: 10.17238/PmJ1609-1175.2018.4.5-9. 2. Выделение, очистка и изучение физикохимических свойств ксиланазы штамма Bacillus subtilis 9/ Л.Р. Валиуллин, Р.С. Мухаммадиев, Р.С. Мухаммадиев, В.И. Егоров, А.П. Глинушкин// Достижения науки и техники АПК. 2021. Т. 35. № 10. С. 66-71. DOI: 10 .53859/02352451_2021_35_10_66. 3. Выявление и количественная оценка вирусных и бактериальных возбудителей респираторных болезней крупного рогатого скота при помощи ПЦР в реальном времени/ А.В. Нефедченко, А.Г. Глотов, С.В. Котенева, Т.И. Глотова// Сельскохозяйственная биология. 2021. Т. 56. № 4. С. 695-706. DOI: 10.15389/ agrobiology.2021.4.695rus. 4. Оптимизация схем гипериммунизации лабораторных животных высокоочи-щенным антигеном вируса бешенства/ А.Г. Мухамеджанова, Р.М. Ахмадеев, Н.Р. Мифтахов, Ш.М. Насыров, З.З. Алеева, Г.М. Яруллина, Г.С. Арутюнян// Ветеринария. 2020. № 10. С. 25-29. DOI: 10.30896/0042-4846.2020.23.10.25-29. 5. Очистка аденоассоциированного вируса DJ методом анионообменной хроматографии: оптимизация условий/ Д.В. Глазкова, Е.А. Михайлюк, Г.А. Шипулин, Е.В. Богословская// Биотехнология. 2023. Т. 39. № 4. С. 68-80. DOI: 10.56304/ S023427582304004X. 6. Очистка антигенов вируса лейкоза крупного рогатого скота методом ультрацентрифугирования/ М.Е. Горбунова, К.В. Усольцев, Р.И. Шангараев, Е.А. Громова, К.С. Хаертынов, А.Г. Галеева// Ветеринарный врач. 2024. № 2. С. 43-48. DOI: 10.33632/1998-698X_2024_2_43. 7. Получение антигена вируса бешенства методом трёхфазной экстракции/ Р.М. Ахмадеев, А.Г. Мухамеджанова, Н.Р. Мифтахов, Ш.М. Насыров, И.И. Самерха-нов, З.З. Алеева, Г.С. Арутюнян, Г.М. Яруллина// Ветеринарный врач. 2020. № 5. С. 26-33. DOI: 10.33632/1998-698X.2020-5-26-33 8. Сергеев В.А., Непоклонов Е.А., Алипер Т.И. Вирусы и вирусные вакцины: монография. - М.: Библионика, 2007. - 524 с. 9. Усовершенствование технологии культивирования вирусов парагриппа-3 и инфекционного ринотрахеита для изготовления ассоциированных вакцин КРС/ И.Г. Каримуллина, В.Г. Гумеров, А.И. Яруллин, Р.С. Мухаммадиев, Д.Н. Мингалеев, Д.А. Сорокина// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2024. Т. 259. № 3. С. 78-82. DOI: 10.31588/2413 _4201_1883_3_259_78. 10. Эффективность различных методов выращивания вируса африканской чумы свиней в гемопоэтических клетках/ Н.И. Закутский, Т.Г. Широкова, Н.С. Неверовская, С.Г. Юрков// Сельскохозяйственная биология. 2014. Т. 49. № 4. С. 58-63. DOI: 10.15389/agrobiology.2014.4.58rus. 11. Alves Dummer L., Pereira Leivas Leite F., van Drunen Littel-van den Hurk S. Bovine herpesvirus glycoprotein D: a review of its structural characteristics and applications in vaccinology// Vet. Res. 2014. 45(1):111-123. DOI: 10.1186/s13567-014-0111-x. 12. Antagonistic properties and biocompatibility as important principles for development of effective and biosafety probiotic drugs/ Rish.S. Mukhammadiev, A.S. Mukhammadieva, E.V. Skvortsov, E.V. Skvortsov, L.R. Valiullin, A.P. Glinushkin// IOP Conf. Ser. Earth Environ. Sci. 2021. 663. 012008. DOI:10.1088/1755-1315/663/1/012008. 13. Assessment of BoAHV-1 seronegative latent carrier by the administration of two infectious bovine rhinotracheitis live marker vaccines in calves/ S. Petrini, C. Righi, G. Costantino, E. Scoccia, P. Gobbi, C. Pellegrini, M. Pela, M. Giammarioli, G. Viola, R. Sabato, E. Tinelli, F. Feliziani// Vaccines (Basel). 2024. 12(2). 161-173. DOI: 10.3390/ vaccines12020161. 14. Bovine alphaherpesvirus-1 (BoHV-1) infection in cattle: an overview of epidemiology, role of envelope proteins in disease and control/ L. Rashmi, R. Sharada, D. Ratnamma, S. Isloor, B.M. Chandranaik, H.V. Mohan, Y.S.R. Devi, S. Ranganatha, S.S. Patil// Indian. J. Anim. Res. 2024. 5136. 1-12. DOI: 10.18805/IJAR.B-5136. 15. Construction, characterization and immunogenicity of a glycoprotein E negative bovine herpesvirus-1.1 Egyptian strain «Abu-Hammad»/ A.A. El-Kholy, D.I. Rady, E.R. Abdou, M.M. Elseafy, K.A. Abdelrahman, H. Soliman// J. Virol. Methods. 2013. 194(12). 74-81. DOI: 10.1016/j.jviromet.2013.07.041. 16. Establishment of a real-time fluorescent quantitative PCR detection method and phylogenetic analysis of BoAHV-1/ L. Xu, G. Ge, D. Li, J. Li, Q. Gong, K. Shi, F. Liu, N. Diao, Z. Cui, Y. Liu, X. Leng, R. Du// B.M.C. Vet. Res. 2024. 20(1). 180-192. DOI: 10.1186/s12917-024-04025-8. 17. Infectious bovine rhinotracheitis (IBR): unveiling the hidden threat to livestock productivity and global trade/ R. Rimayanti, A.R. Khairullah, T.D. Lestari, I.B. Moses, S. Utama, R. Damayanti, S. Mulyati, H.M. Raharjo, M.K.J. Kusala, R. Raissa, S. Wibowo, S.R. Abdila, K.A. Fauzia, S.M. Yanestria, I. Fauziah, J.E. Siregar// Open. Vet. J. 2024. 14(10). 2525-2538. DOI:10.5455/OVJ.2024.v14.i10.3. 18. Infectious bovine rhinotracheitis post-eradication program in the autonomous province of Bolzano, Italy: a retrospective study on potential bovine herpesvirus type 2 cross-reactivity/ A. Bettini, M. Stella, F. Precazzini, M. Degasperi, S. Colorio, A.Tavella// Animals (Basel). 2023. 13(22). 3502-3600. DOI: 10.3390/ani13223502. 19. Isolation, purification, and characterization of a lectin from the fungus Fusarium solani 4/ R.S. Mukhammadiev, E.V. Skvortsov, L.R. Valiullin, A.P. Glinushkin, T.V. Bagaeva, R.S. Mukhammadiev// Applied Biochemistry and Microbiology. 2021. 57(2). 206-211. DOI: 10.31857/S0555109921020094. 20. Krishnagopal A., van Drunen Littel-van den Hurk S. The biology and development of vaccines for bovine alphaherpesvirus 1// Vet. J. 2024. 306. 106152. DOI: 10.1016/j.tvjl.2024.106152. 21. Optimization of conditions for cultivation of pathogens of infectious rhinotracheitis and viral diarrhea/ I. Karimullina, A. Yarullin, R. Mukhammadiev, R. Mukhammadiev, D. Mingaleev, G. Khusainova, D. Sorokina, V. Gumerov// BIO Web of Conferences. 2024. 06012. DOI: 10.1051/bioconf/202411606012. 22. Phylogenetic analysis and characterization of bovine herpesvirus-1 in cattle of China, 2016-2019/ Y. Zhou, X. Li, Y. Ren, X. Hou, Y. Liu, S. Wei, G. Dai, Y. Meng, L. Hu, Z. Liu, W. Jia, Z. Zhu, R. Wu// Infect. Genet. Evol. 2020. 85.104416. DOI: 10.1016/j. meegid.2020.104416. 23. Purification of anatid herpesvirus 1 particles by tangential-flow ultrafiltration and sucrose gradient ultracentrifugation/ Y. Guo, A. Cheng, M. Wang, Y. Zhou// J. Virol. Methods. 2009. 161(1). 1-6. DOI: 10.1016/j.jviromet.2008.12.017. 24. The role of sheep in the epidemiology of bovine alphaherpesvirus 1 (BoHV-1)/ M. Pourmahdi Borujeni, M.R. Haji Hajikolaei, M.R. Seifi Abad Shapouri, F. Roshani// Prev. Vet. Med. 2020. 174. 104818. DOI: 10.1016/j.prevetmed.2019.104818. 25. TLR activation, immune response and viral protection elicited in cattle by a commercial vaccine against bovine herpesvirus-1/ C.A. Kornuta, F Cheuquepan, J.E. Bidart, I. Soria, M. Gammella, V. Quattrocchi, Y.P. Hecker, D.P. Moore, S.A. Romera, M.S. Marin, P.I. Zamorano, C.A. Langellotti// Virology. 2022. 566. 98-105. DOI: 10.1016/j.virol.2021.11.014. Сведения об авторах: Каримуллина Ильсияр Габделгазизовна, кандидат биологических наук, старший научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-904-7699225; e-mail: 89047699225@mail.ru. Яруллин Айнур Ильнурович, кандидат биологических наук, заведующий отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-905-3174170; e-mail: abii@mail.ru. Сорокина Диана Анатольевна, младший научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-927-8875729; e-mail: diana-sorokina2013@mail.ru. Хаертынов Камиль Саубанович, кандидат биологических наук, ведущий научный сотрудник отделения биохимии и генетического анализа ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4078770; e-mail:khaerkamil@mail.ru. Галеева Антонина Глебовна, кандидат ветеринарных наук, ведущий научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-897-2338616; e-mail: antonina-95@yandex.ru. Мухаммадиев Ринат Салаватович, кандидат биологических наук, старший научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБ-НУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; e-mail: tanirtashir@mail.ru. Хафизова Алсу Магъфуровна, младший научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-927-4294978; e-mail: alsukhafizova@yandex.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, старший научный сотрудник отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; e-mail: tashir9891@mail.ru. Заявленный вклад авторов: Мухаммадиев Риш.С.: разработка концепции, научное руководство, написание рукописи - редактирование. Каримуллина И.Г.: административное руководство исследовательской работой, написание черновика рукописи Яруллин А.И.: курирование данных, предоставление ресурсов Сорокина Д.А.: проведение исследования, валидация результатов. Хаертынов К.С.: разработка методологии, проведение исследования. Галеева А.Г.: формальный анализ Мухаммадиев Рин.С.: валидация результатов, визуализация. Хафизова А.М.: проведение исследования. Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|