|
||||

Оптимизация параметров совместного культивирования Bacillus Subtilis GA27 и Bacillus Subtilis RF-45 для возможности создания пробиотиков, метапробиотиков и метабиотиков для птицеводстваУДК 579.62 Мухаммадиев Риш. С., Мухаммадиев Рин. С., Валиуллин Л. Р. Федеральное государственное В современной науке термин «микробиоценоз» опре-деляется как единая система макроорганизма и его микробиом, представляющий собой разнообразные существующие в биотопе сообщества микроорганизмов и продукты их метаболизма [3]. Появляется больше свидетельств, указывающих на то, что различные абиотические, биотические и антропогенные факторы среды способны существенно воздействовать на процессы метаболизма, иммунного ответа и восприимчивость молодняка сельскохозяйственной птицы к заболеваниям различных систем органов путем изменения микробиоты в их желудочно-кишечном тракте [3, 17]. Следует отметить, что массовое и бессистемное использование антимикробных препаратов и синтетических добавок в сельском хозяйстве привело к усилению развития у бактерий множественной резистентности, снижению эффективности антибиотикотерапии и многочисленным проявлениям дисбактериоза кишечника у животных [4, 8, 22]. В этой связи становится значимой задачей проблема исследования микробной экологии макроорганизма, а также входящих в него симбионтных и пробиотических бактерий. Согласно определению, которое введено экспертами Всемирной организации здравоохранения (ВОЗ, World Health Organization, WHO), продовольственной и сельскохозяйственной организацией ООН (ФАО, Food and Agriculture Organization, FAO), пробиотики означают «живые микроорганизмы, использование которых в достаточном количестве приносит благоприятное воздействие на здоровье макроорганизма» [8, 10]. В большинстве случаев в их качестве применяют представителей порядка Lactobacillales (рода Lactobacillus, Lactococcus, Pediococcus, Streptococcus и Leuconostoc), относящиеся в группу молочнокислых бактерий [9, 24]. В последние годы в состав моновидовых пробиотиков и комплексных препаратов для птицеводства все больше включают представителей рода Bacillus [5, 20, 31]. Наметившаяся тенденция по использованию бактерий этой группы в качестве кормовых добавок с пробиотическими свойствами определяется бесспорными их преимуществами относительно молочнокислых микроорганизмов [4, 8, 26]. В этом плане особый интерес исследователей и птицеводов вызывают добавки на основе нескольких штаммов бацилл, которые способны компенсировать, расширять или усиливать функциональные свойства друг друга [5, 27, 40]. Установлено, что бактерии рода Bacillus sp. способны к коррекции состава микробиоценоза желудочно-кишечного тракта, усилению иммунной системы и усвоения различных компонентов рациона, деструкции токсичных и аллергенных веществ, выведению тяжелых металлов из организма птицы [20, 28, 31]. Вышеуказанные позитивные эффекты бациллярных штаммов на организм хозяина возможны вследствие их способности к образованию витаминов (P, К2 и группы B), аминокислот (треонин, триптофан, метионин, лейцин, лизин, цистеин, аргинин), антимикробных метаболитов (дипиколиновая кислота, циклические липопептиды, бактериоцины, лизоцим, литические ферменты), гидролаз (ксиланаза, целлюлаза, пектиназа, амилаза, протеаза, липаза, фитаза), антиоксидантов (каталаза, пероксидаза, супероксиддисмутаза), иммуномодулирующих соединений (бактериоцины, биосурфактанты, экзополисахариды, сидерофоры) и многих других метаболитов [5, 35, 39]. На сегодняшний день в области птицеводства активно развивается направление использования добавок, содержащих пробиотические микроорганизмы и/или биологически активные метаболиты (метапробиотики, метабиотики), в жидкой форме [13, 29]. Последние обладают эксплуатационными преимуществами и высокой эффективностью с точки зрения их функциональных свойств [10, 13, 25]. Для успешного производства указанных добавок колоссальное значение имеет отработанная технология их получения, которая включает оптимизацию состава питательной среды, температуру и продолжительность выращивания микроорганизмов, интенсивность аэрации. Во Всероссийском научно-исследовательском институте фитопатологии выделены штаммы B. subtilis GA27 и B. subtilis RF-45, обладающие выраженным антимикробным потенциалом в отношении возбудителей кишечных инфекций молодняка птицы и способностью к образованию биологически активных метаболитов, включая ферментов гидролитического действия [1]. Целью настоящей работы служила оптимизация параметров совместного культивирования B. subtilis GA27 и B. subtilis RF-45 для возможности создания пробиотиков, метапробиотиков и ме-табиотиков для птицеводства. Материалы и методы исследований. Объектами исследований являлись биосовместимые между собой штаммы B. subtilis GA27 и B. subtilis RF-45 из фонда Коллекции микроорганизмов Всероссийского научно-исследовательского института фитопатологии (Московская обл., Одинцовский р-н, Россия). Бактериальные культуры поддерживали путем периодических пересевов при температуре (4±1) °С на агаризованную среду LB (Luria Bertani) (Condalab, Испания). В качестве тест-объектов применяли изолированные из биоматериала погибшего молодняка сельскохозяйственной птицы с клиническими симптомами кишечных инфекций грамположительные Staphylococcus aureus и грамотрицательные бактерии Escherichia coli, и Salmonella sp. (из коллекции ФГБНУ ВНИИФ). Поддержание тест-культур и их выращивание проводили на указанной нами ранее питательной среде для роста микроорганизмов [4]. Для экспериментов по выбору оптимальной для совместного глубинного культивирования штаммов бацилл питательной среды исходным служила среда, включающая 12,0 г/л мелассы, 1,5 г/л KH2PO4, 1,0 г/л NaCl, 0,4 г/л MgSO4, 2,0 мг/л MnSO45H2O, 0,14 мг/л ZnSO47H2O, 0,002 мг/л KI (начальное значение pH среды - 6,2). В исследовании использовали следующие варианты жидких сред: кукурузная (в качестве источника углерода применяли кукурузную муку в концентрации 3,8 %), соевая (соевую муку -3,8 %), соево-кукурузная (соевую и кукурузную муку в концентрации соответственно 1,9 и 1,9 %), кукурузная с добавлением 0,5 % пшеничных отрубей, соевая с добавлением 0,5 % пшеничных отрубей и соево-кукурузная с добавлением 0,5 % пшеничных отрубей [42]. Контролем служила питательная среда 863, содержащая (г/л) 10,0 пептон, 10,0 дрожжевой экстракт и 20,0 глюкозу [16]. Выращивание бацилл осуществляли в колбах Эрленмейера объёмом 250 мл с 50 мл среды при интенсивности качания 150 об./мин и температуре (37±1) °C в течение 16 ч. В качестве посевного материала применяли стационарные культуры с общим титром (1,35±0,15)x107 КОЕ/мл, вносили его в количестве 5 % от объема среды для роста бактерий, соотношение B. subtilis GA27 и B. subtilis RF-45 в инокуляте - соответственно 1:1. В качестве критерий оптимального состава питательной среды использовали количественные параметры накопления биомассы штаммов (КОЕ/мл) [21]. При проведении исследований по подбору оптимальных параметров совместного культивирования бацилл на отобранной питательной среде устанавливали зависимость динамики накопления их бактериальных клеток от количества (6,0x105, 2,0x106, 6,0x106 КОЕ/мл) и соотношения (1:1, 1:2, 2:1) вносимых штаммов, условий аэрации (скорость перемешивания 120, 150 и 180 об/мин) и длительности процесса выращивания (до 24 ч). На каждом этапе инкубации бактерий осуществляли отбор культуральной жидкости для установления кислотности последней по ГОСТ Р 56145-2014. Влияние температуры культивирования на выход биомассы бацилл и продукцию ими антимикробных метаболитов определяли при значениях 28, 35 и 42 °C, начальной активной кислотности жидкой среды - при рН 5,5, 6,5, 7,5. Жизнеспособность и численность бактериальных клеток каждого бациллярного штамма в культуральной жидкости оценивали высевом ее предельных разведений на агаризованную среду LB (Condalab, Испания) с последующим подсчетом выросших колоний (КОЕ/мл) по истечении периода инкубации [16]. Антимикробный потенциал бациллярной ассоциации в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы устанавливали с помощью метода диффузии в агар [4, 21]. Из культуральной жидкости, полученной после совместного культивирования исследуемых штаммов в оптимальных для их роста условиях, осаждали бактериальные клетки центрифугированием при 4 тыс. g в течение 10 мин [38]. Биомассу бацилл суспендировали в стерильном физиологическом растворе для получения клеточной суспензии с титром (2,81±0,24)x109 КОЕ/мл [28]. Полученный бесклеточный культуральный супернатант отбирали и стерилизовали путем фильтрования, используя стерильные мембранные насадки Millex с размером пор 0.22 мкм (Merck Millipore, США) [11]. В слое агара с тест-штаммом вырезали лунки диаметром 10 мм, вносили 100 мкл клеточной суспензии, культуральной жидкости или супернатанта бактериального консорциума и инкубацию вели при (37±1) °C в течение суток. По зоне задержки роста вокруг лунок судили о степени антимикробной активности бациллярной ассоциации по отношению к возбудителям кишечных инфекций птицы. Исследования с применением лабораторных животных осуществляли в соответствии с принципами Европейской Конвенции по защите позвоночных животных (Страсбург, 1986) и требованиями, указанными в Директиве Европейского Парламента и Совете Европейского Союза [19]. Сравнительную оценку эффективности клеточной суспензии, культуральной жидкости или супернатанта бациллярной ассоциации в коррекции микроэкологических нарушений кишечника животных проводили на прошедших акклиматизацию 40 крысах линии Wistar ((самцы, живая масса 200-220 г, возраст 7-8 недель) на модели антибиотик-индуцированного дисбиоза [14]. Дисбиоз у животных вызывали путем ежедневного внутрижелудочного введения зондом гентамицина сульфата в дозе 90 мг на 1 кг живой массы тела в течение 8 суток [7]. После прекращения введения антибиотика крыс разделяли на 4 групп по 10 животных в каждой:
По окончании исследования (на 8 сутки) крыс контрольной и опытных групп подвергали эвтаназии и осуществляли патологоанатомическое их вскрытие для забора фекальных масс из толстой кишки [15]. С целью возможности количественного определения групп микроорганизмов в навеску из содержимого кишечника животных массой 1,0 г вносили стерильный физиологический раствор в объеме 9,0 мл. Из получившейся суспензии готовили ряд последовательных 10-кратных разведений, которые переносили в соответствующие питательные среды [8]. Общее содержание микроорганизмов в фекальных массах животных устанавливали на питательном агаре (Plate Count Agar) (Merck KGaA, Германия) для подсчета КМАФАнММПА (посев глубинным и поверхностным способами) [40], молочнокислые бактерии (лакто- и бифидобактерии) - капустном агаре (посев глубинным методом), бактерии группы кишечной палочки - среде Эндо (ФБУН ГНЦ ПМБ, Россия) (посев поверхностным способом) [8]. Статистическую обработка полученных после исследований результатов осуществляли согласно стандартным методикам [4] с применением программы Microsoft Excel 2016. Полученные данные на графиках и в таблицах представлены в виде средних арифметических значений и их доверительных интервал, которые рассчитаны по стандартным ошибкам. Установление различий выборочных средних проводили согласно t-критерию Стьюдента при p < 0,05 с помощью программ Microsoft Excel 2016 и Statisticav. 12.0 (StatSoft, Inc., США). Результаты исследований и их обсуждение. Одним из важнейших показателей рентабельности биопрепаратов на рынке кормовых добавок является экономически и технологически обоснованный подход к их получению [25, 36]. Согласно литературным данным, глубинное выращивание - приоритетный метод, позволяющий получить биопрепараты в жидкой форме, в связи с технологическими, экономическими и экологическими преимуществами процесса в масштабах широкого производства [21]. В этом плане особую значимость приобретает способ совместного культивирования микроорганизмов, поскольку продукт, получаемый при таком выращивании, способен обладать повышенными функциональными свойствами [27, 36]. Необходимо отметить, что сведения относительно совместного глубинного выращивания штаммов бацилл для возможности создания метапробиотиков и метабиоти-ков в отечественной и зарубежной литературе отсутствуют. Для выбора оптимальной для глубинного выращивания B. subtilis GA27 и B. subtilis RF-45 питательной среды проводили раздельное и совместное их культивирование на средах с добавлением различных дешевых источников питания - компонентов кормов цыплят-бройлеров (соевой и кукурузной муки, пшеничных отрубей) (табл. 1). Таблица 1 Рост штаммов B. subtilis GA27 и B. subtilis RF-45 в условиях раздельного и совместного их культивирования на разных жидких средах
Примечание: результаты получены после культивирования бацилл при 37°С и интенсивности качания 150 об./мин в течение 16 ч, начальное значение рН среды - 6,2, соотношение посевных концентраций B. subtilis GA27 и B. subtilis RF-45 1:1. При совместном росте B. subtilis GA27 и B. subtilis RF-45 на жидких питательных средах, содержащих соевую и кукурузную муку, показано отсутствие существенных различий в их продуктивности. Так, после 16-часового совместного культивирования исследуемых бациллярных штаммов их численность в кукурузной среде достигала (3,73±0,10)х108 КОЕ/мл, соево-кукурузной - (5,57±0,26)х108 КОЕ/мл. Наиболее оптимальной для накопления биомассы бактерий была соевая среда с добавлением или без внесения 0,5 % пшеничных отрубей. При этом содержание бацилл в указанных условиях эксперимента составило соответственно (1,06±0,14)х109 и (9,19±0,33)х108 КОЕ/мл. Представленные нами данные свидетельствуют об интенсификации процессов роста исследуемых штаммов бацилл и накопления ими биомассы в составе ассоциации относительно монокультур. Схожие результаты были установлены в работе зарубежных исследователей, в котором показано, что при совместном глубинном культивирования B. subtilis УКМ 5139 и B. subtilis УКМ 5140, составляющих основу средства для лечения кишечных инфекций сельскохозяйственных животных, на среде с зеленой патокой и кукурузным экстрактом происходит статистически значимое повышение количества их клеток по сравнению с содержанием бактерий в монокультурах [36]. Получаемые после совместного глубинного выращивания B. subtilis GA27 и B. subtilis RF-45 на соевой среде с добавлением пшеничных отрубей культуральная жидкость и супернатант характеризовались более высоким антагонистическим эффектом в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы по сравнению с культуральной жидкостью и супернатантом, которые получены после роста исследуемых штаммов в ассоциации на данной среде без внесения отрубей (экспериментальные данные не показаны). Результаты исследования согласуются с представленными в литературе данными о влиянии состава питательной среды на уровень антимикробной активности бактерий с пробиотическими свойствами [6]. На выход биомассы микроорганизмов в процессе глубинного их культивирования способны оказывать существенное влияние не только химическая природа источников питания, их соотношение в питательной среде, но количество и возраст посевного материала, температура и рН выращивания, а также интенсивность аэрации [18, 21, 25]. Нами установлено, что наибольшее накопление биомассы исследуемых бациллярных штаммов обеспечивается при температуре 35°С, активной кислотности соевой среды с добавлением 0,5% пшеничных отрубей 6,5, скорости вращения качалки 180 об./мин, продолжительности процесса совместного глубинного их культивирования 16 ч (рисунок 1). В качестве посевного материала при этом необходимо использовать стационарные культуры с общим титром не менее (6,0±0,17)х106 КОЕ/мл и вносить его в количестве 10 % от объема среды для роста. Оптимальное соотношение посевной концентраций B. subtilis GA27 и B. subtilis RF-45 - 1:2.
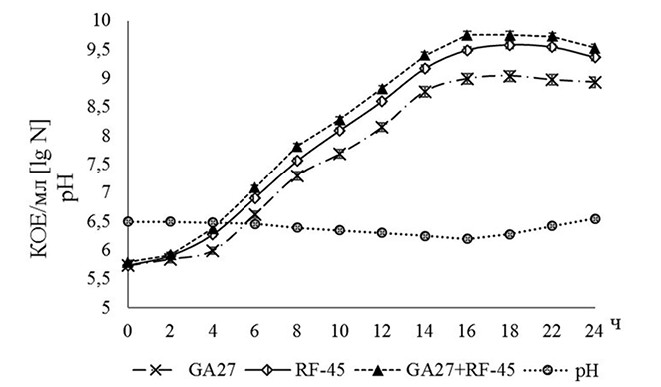
Рис. 1. Динамика изменения бактериальных клеток B. subtilis GA27 и B. subtilis RF-45 и рН соевой среды с добавлением пшеничных отрубей при совместном их культивировании в оптимальных для роста бацилл условиях (рН 6,5, 35°С, 180 об./мин, 24 ч) Исследуемые бациллярные штаммы успешно росли на соевой среде с добавлением пшеничных отрубей, демонстрируя характерную для данных видов бактерий кривую роста. В течении первых 16 ч выращивания отмечали активный рост культур, затем бактерии переходили в стационарную фазу, после 22 ч наблюдали незначительное снижение уровня накопления их биомассы. Максимальное количество бактериальных клеток бацилл наблюдали на 16 ч совместного их культивирования на указанной среде и составило (5,63±0,14)х109 КОЕ/мл. В настоящей работе проведена оценка влияния различных значений температур культивирования и рН соевой среды с добавлением пшеничных отрубей на антимикробный потенциал суспензии бактериальных клеток (СК), культуральной жидкости (КЖ) и супернатанта (КС), полученных после совместного выращивания B. subtilis GA27 и B. subtilis RF-45. Установлено, что наибольшая степень подавления КЖ и КС возбудителей кишечных инфекций молодняка птицы достигается при значении температуры 35 °С (рисунок 2 и 3).
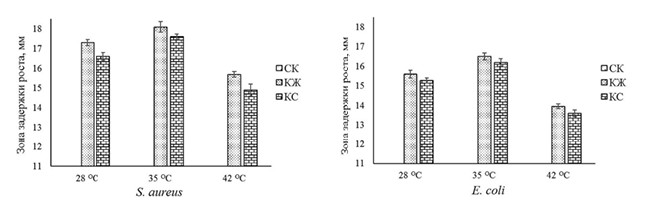
Рис. 2. Влияние различных температур культивирования на антимикробный потенциал СК, КЖ и КС, полученных при совместном выращивании B. subtilis GA27 и B. subtilis RF-45, в отношении S. aureus (слева) и E. coli (справа)
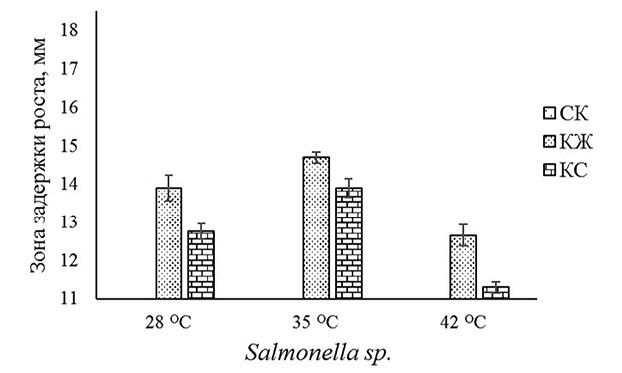
Рис. 3. Влияние различных температур культивирования на антимикробный потенциал СК, КЖ и КС, полученных при совместном выращивании B. subtilis GA27 и B. subtilis RF-45, в отношении Salmonella sp. При пониженной (28°С) и повышенной (42°С) значениях температур выращивания отмечали снижение накопления антимикробных метаболитов штаммами бацилл. Диаметр зон подавления роста тест-объектов КЖ и КС, полученных после совместного выращивания исследуемых бактерий в условиях эксперимента, достоверно уменьшался на 4,3-18,6% в зависимости от возбудителя кишечных инфекций птицы. Изучение влияния рН среды на антимикробный потенциал КЖ и КС ассоциации B. subtilis GA27 и B. subtilis RF-45 показало, что максимальное антагонистическое их действие, соответствующее наибольшему выходу бактериальной биомассы, проявляется при значениях рН 6,5 (табл. 2). Таблица 2 Влияние различных значений рН среды на антимикробный потенциал СК, КЖ и КС консорциума на основе B. subtilis GA27 и B. subtilis RF-45
При пониженной (рН 5,5) и повышенной (pH 7,5) значениях pH среды отмечали незначительное снижение (на 2,8-12,7 %) уровня антимикробного потенциала КЖ и КС ассоциации бацилл. В условиях экспериментального исследования СК, полученная после осаждения последних из КЖ бактериального консорциума, не проявляла антагонистический эффект относительно S. aureus, E. coli и Salmonella sp. В связи с возможностью использования СК, КЖ и КС ассоциации на основе B. subtilis GA27 и B. subtilis RF-45 в качестве соответственно полиштаммового проботика, метапробиотика и метабиоти-ка с пребиотическим (бифидогенным) эффектом для птицеводства проведена оценка их эффективности при коррекции нарушений кишечной микробиоты у крыс линии Wistar с гентамицин-индуциро-ванным дисбиозом. Следует отметить, что в просматриваемой нами литературе данных об сравнительной эффективности указанных добавок, одновременно полученных с использованием определенных штаммов или консорциумов на их основе, в лечении кишечных инфекций животных и человека отсутствуют. Проведенный анализ содержимого кишечника крыс контрольной и опытных групп показал, что применение КЖ и КС бациллярной ассоциации приводило к повышению численности представителей нормальной микробиоты кишечника животных -молочнокислых микроорганизмов и бактерий группы кишечной палочки до уровней, соответствующих их физиологическим параметрам (табл. 3). Таблица 3 Численность микроорганизмов (КОЕ/г фекалия) в кишечном содержимом самцов крыс линии Wistar с антибиотик-индуцированным дисбиозом на фоне применения СК, КЖ и КС ассоциации B. subtilis GA27 и B. subtilis RF-45
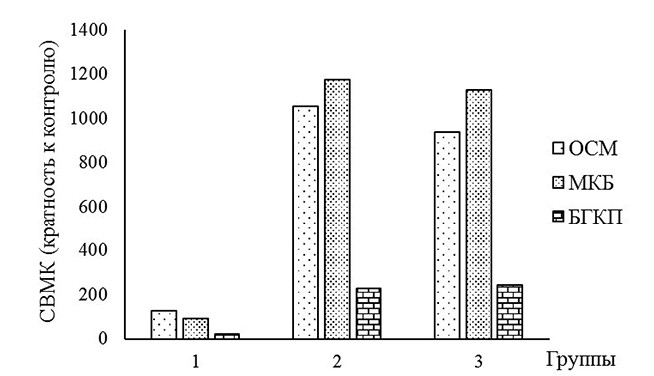
Примечание: группа 1 - животные, получавшие СК ассоциации штаммов B. subtilis GA27 и B. subtilis RF-45, группа 2 - КЖ бактериальной ассоциации; группа 3 - КС бактериальной ассоциации; контроль (группа самовосстановления кишечной микробиоты) -основу СК бактериальной ассоциации (физиологический раствор) *ОСМ - общее содержание микроорганизмов, МКБ - молочнокислые бактерии, БГКП - бактерии группы кишечной палочки Сравнительная оценка показателей опытных групп животных показала следующее: в группе 2 общее содержание микроорганизмов было выше в 1,12 и 8,35 раз (p<0,05), количество молочнокислых микроорганизмов - в 1,04 (p>0,05) и 13,03 (p<0,05) раза по сравнению с группами 3 и 1, соответственно. В указанной группе животных численность бактерий группы эшерихии была больше в 10,49 раз (p<0,05) и меньше в 1,08 раз (p>0,05) относительно соответственно групп 1 и 3. Как известно, спорообразующие бактерии рода Bacillus модулируют микробиоту кишечника и избирательно способствуют росту молочнокислых микроорганизмов [8]. Так, в работах отечественных и зарубежных учёных показано, что штаммы Bacillus subtilis обладают стимулирующим эффектом на рост Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus rhamnosus, Lactobacillus reuteri, Streptococcus lactis, Lactobacillus casei, Lactobacillus murinus [12, 32, 33, 34, 37]. Согласно теории «Биологического захвата кислорода» («Biological Oxygen-Capturing Theory»), создаваемая при росте B. subtilis анаэробная среда играет ключевое значение в процессе стимуляции роста лактобактерий [41]. За рубежом начали появляться сведения, которые касаются способности образуемых бациллами метаболитов, включая циклических дипептидов, поверхностных белков, субти-лизина, антиоксидантных (каталаза, супероксиддисмутаза) и гидролитических (амилаза, протеаза) ферментов, стимулировать в модельных условиях развитие тест-культур молочнокислых микроорганизмов [30, 33, 34, 41]. Универсальным показателем, который характеризует количественные изменения кишечной микрофлоры животных в эксперименте под влиянием разрабатываемых средств лечения кишечных инфекций и позволяет установить их эффективность, является скорость восстановления микробиоты кишечника (СВМК) [23]. На модели индуцированного антимикробным препаратом дисбиоза у крыс линии Wistar исследован вышеуказанный показатель СК, КЖ и КС консорциума на основе B. subtilis GA27 и B. subtilis RF-45 (рис. 4).
Рис. 4. Сравнительное исследование in vivo эффективности СК, КЖ и КС ассоциации B. subtilis GA27 и B. subtilis RF-45 (группа 1 - животные, получавшие СК бациллярной ассоциации, группа 2 - КЖ бациллярной ассоциации; группа 3 - КС бациллярной ассоциации) По сравнению с СК и КС бактериальной ассоциации КЖ обладала наиболее высокой СВМК животных. Скорость восстановления общей численности кишечных микроорганизмов, количества молочнокислых бактерий под влиянием КЖ бациллярного консорциума была выше, соответственно, в 1053 и 1174 раза относительно контроля (самовосстановлением микробиоты кишечника). КС бактериальной ассоциации не значительно уступала по терапевтической эффективности ее КЖ: скорость восстановления общего содержания кишечных микроорганизмов, количества молочнокислых бактерий была больше соответственно в 939 и 1127 раз по сравнению с контролем. Пероральное введение СК бациллярного консорциума животным с антибиотик-индуциро-ванным дисбиозом оказывало наименьшее влияния на СВМК. По скорости восстановления бактерий группы кишечной палочки СК, КЖ и КС ассоциации B. subtilis GA27 и B. subtilis RF-45 превосходили в 22-245 раз аналогичный показатель контрольной группы животных, при этом наиболее эффективным в этом плане был КС бактериального консорциума. Более высокие значения СВМК крыс с гентамицин-индуциро-ванным дисбиозом на фоне использования КЖ и КС по сравнению с СК бациллярной ассоциации, возможно, обусловлены входящими в их состав биологически активными метаболитами и остатками (компонентами) среды как пребиотическими факторами. Низкое значение СВМК опытных животных, получавших СК бактериального консорциума, скорее всего, связано с низкой выживаемостью и/или приживаемостью штаммов бацилл в их кишечнике. Анализ полученных в настоящем исследовании результатов свидетельствуют о более низкой эффективности пробиотиков относительно метапробиотиков и метабиотиков как средств терапии кишечных инфекций животных. Подобные данные представлены в работе отечественных исследователей, в котором показано, что СВМК белых мышей с антибиотик-индуцированным дисбиозом под воздействием метаболитов надосадочной жидкости L. plantarum 8P-A3 (метабиотикотерапия) превышает аналогичный показатель в группе животных, получавших аутоштаммы бифидобактерий и лактобактерий (пробиотикотерапия), в 1420 и 2209 раза, соответственно [2]. Заключение. На основании проведенных исследований определены оптимальные параметры совместного культивирования штаммов B. subtilis GA27 и B. subtilis RF-45, включающие факторы роста, количество посевного материала, соотношение вносимых штаммов, активную кислотность среды, условия аэрации (скорость перемешивания), температуру и продолжительность процесса инкубации, соблюдение которых обеспечивает получению КЖ и КС бациллярной ассоциации с высоким уровнем антимикробного потенциала в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы и эффективности при коррекции нарушений кишечной микробиоты у животных с антибиотик-индуцированным дисбиозом. Работа выполнена при финансовой поддержке гранта Президента Российской Федерации № МК-2439.2022.5 «Новые подходы с использованием пробиотиков, метабиотиков и бактериальных ферментов для коррекции вызванных действием патогенных факторов микроэкологических нарушений кишечника молодняка сельскохозяйственной птицы» (соглашение № 075-15-2022-414/1 от «30» марта 2023 г.). Авторы выражают огромную благодарность Шамилю Завдатовичу Валидову (НИЛ «Микробные биотехнологии» ИФМиБ Казанского (Приволжского) федерального университета), Алексею Анатольевичу Набатову (кафедра биохимии Казанского государственного медицинского университета) и Татьяне Вадимовне Багаевой (кафедра биохимии, биотехнологии и фармакологии ИФМиБ Казанского (Приволжского) федерального университета) за помощь и ценные советы по проведению аналитических экспериментов. Список литературы: 1. Антагонистическая активность новых штаммов микроорганизмов в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, А.С. Мухаммадиева, Л.Р. Валиуллин// Молодежные разработки и инновации в решении приоритетных задач АПК: материалы Международной научной конференции студентов, аспирантов и учащейся молодежи. Казань: Казанская государственная академия ветеринарной медицины имени Н.Э. Баумана, 2022. С. 348-350. 2. Аутопробиотикотерапия/ И.Ю. Чичерин, И.П. Погорельский, И.А. Лундов-ских, К.Е. Гаврилов, М.Р. Шабалина, И.В. Дармов// Журнал инфектологии. 2013. Т. 5. № 4. С. 43-54. 3. Бактериальное сообщество слепых отростков кишечника цыплят-бройлеров на фоне питательных рационов различной структуры/ В.И. Фисинин, Л.А. Ильина, Е.А. Йылдырым, И.Н. Никонов, В.А. Филиппова, Г.Ю. Лаптев, Н.И. Новикова, А.А. Грозина, Т.Н. Ленкова, В.А. Манукян, И.А. Егоров// Микробиология. 2016. Т. 85. № 4. С. 472-480. 4. Бактерии - антагонисты возбудителей кишечных инфекций и продуценты комплекса целлюлаз как основа для создания добавок, объединяющих функции пробиотика и кормового фермента/ Л.Р. Валиуллин, Риш.С. Мухаммадиев, Рин.С. Мухаммадиев, В.И. Егоров, В.Ю. Рудь, А.П. Глинушкин// Достижения науки и техники АПК. 2021. Т. 35. № 9. С. 60-66. 5. Биопрепараты микробного происхождения в птицеводстве/ Н.В. Феоктистова, А.М. Марданова, М.Т. Лутфуллин, Л.М. Богомольная, М.Р. Шарипова// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2018. Т. 160. № 3. С. 395-418. 6. Биосинтез антимикробных бактериоциноподобных соединений штаммом Lactobacillus reuteri LR1: оптимизация условий культивирования/ А.В. Бегунова, И.В. Рожкова, Т.И. Ширшова, О.А. Глазунова, Т.В. Федорова// Биотехнология. 2019. Т. 35. № 5. С. 58-69. 7. Влияние биологически активной субстанции из Medusomyces gisevii на показатели фагоцитарной активности нейтрофилов крови белых крыс/ Ю.М. Добрыня, Л.Д. Тимченко, Н.И. Бондарева, С.И. Писков// Аграрный вестник Урала. 2018. № 1. С. 8-11. 8. Влияние пробиотиков Bacillus subtilis GM2 и GM5 на рост и усвояемость кормов у цыплят-бройлеров/ Г.Ф. Хадиева, М.Т. Лутфуллин, А.А. Николаева, Н.К. Мочалова, С.Ю. Смоленцев, А.М. Марданова, М.Р. Шарипова// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2019. Т. 161, кн. 3. С. 472-489. 9. Выделение и изучение морфологических и биохимических свойств новых штаммов молочнокислых бактерий, перспективных для создания пробиотических препаратов/ А.С. Мухаммадиева, Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин// Ветеринарный врач. 2020. № 3. С. 39-46. 10. Грицинская В.Л. Пробиотики: классификация, основные характеристики, требования к пробиотическим штаммам и сфера их применения// Научно-практический медицинский журнал. 2022. Т. 10. № 3. С. 12-20. 11. Зорина А.С., Максимова Ю.Г., Демаков В.А. Биопленкообразование моно- и смешанных культур штаммов Alcaligenes faecalis 2 и Rhodococcus ruber GT 1// Микробиология. 2019. Т. 88. № 2. С. 175-183. 12. Изучение механизмов пробиотического действия штамма Bacillus subtilis 8130/ Н.А. Ушакова, Е.В. Котенкова, А.А. Козлова, А.В. Нифатов// Прикладная биохимия и микробиология. 2006. Т. 42. № 3. С. 285-291. 13. Инновационные синбиотики для сельскохозяйственных животных и птицы/ Л.А. Неминущая, И.В. Павленко, А.А. Казаку, Т.А. Скотникова, Ю.Д. Фролов// Ветеринарный врач. 2023. № 1. С. 42-50. 14. Микрофлора кишечника крыс при экспериментальном антибиотикоассоциированном дисбиозе и возможность ее коррекции препаратом на основе молочнокислых и пропионовокислых микроорганизмов/ А.С. Мухаммадиева, Р.С. Мухаммадиев, К.В. Усольцев, Р.С. Мухаммадиев, Е.В. Скворцов, Л.Р. Валиуллин// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2021. Т. 246. № 2. С. 141-145. 15. Молочнокислые и пропионовокислые бактерии: формирование сообщества для получения функциональных продуктов с бифидогенными и гипотензивными свойствами/ А.В. Бегунова, И.В. Рожкова, Е.А. Зверева, О.А. Глазунова, Т.В. Фёдорова// Прикладная биохимия и микробиология. 2019. Т. 55. № 6. С. 566-577. 16. Новые штаммы Bacillus subtilis как перспективные пробиотики/ Г.Ф. Ха-диева, М.Т. Лутфуллин, Н.К. Мочалова, О.А. Ленина, М.Р. Шарипова, А.М. Марда-нова// Микробиология. 2018. Т. 87. № 4. С. 356-365. 17. Новые штаммы Lactobacillus acidophilus как перспективные пробиотики для птицеводства/ Л.Р. Валиуллин, Р.С. Мухаммадиев, Р.С. Мухаммадиев, Р.Р. Тимер-баева, И.Г. Каримуллина, А.И. Яруллин// Ветеринария Кубани. 2022. № 6. С. 16-21. 18. Оптимизация состава питательной среды пробиотического штамма B. subtilis GA24 - продуцента кормовых ферментов/ Р.С. Мухаммадиев, Л.Р. Валиуллин, Р.С. Мухаммадиев, А.С. Мухаммадиева, А.С. Сайфуллин, А.П. Глинуш-кин// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2022. Т. 250. № 2. С. 155-159 19. Параметры острой токсичности и кожно-раздражающего потенциала кормовой композиции с метапробиотическими свойствами/ Г.Л. Латыпов, А.С. Му-хаммадиева, Л.Р. Валиуллин, Р.З. Гибадуллин, Р.С. Мухаммадиев, Р.С. Мухамма-диев, А.П. Глинушкин// Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2023. Т. 253. № 1. С. 174-179. 20. Пробиотики на основе бактерий рода Bacillus в птицеводстве/ Н.В. Феоктистова, А.М. Марданова, Г.Ф. Хадиева, М.Р. Шарипова// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2017. Т. 159. № 1. С. 85-107. 21. Сираева З.Ю., Захарова Н.Г., Ильинская О.Н. Технология получения и оценка стабильности при хранении жидкой препаративной формы биофунгицида Баци-зулин// Учен. зап. Казан. ун-та. Сер. Естеств. науки. 2010. Т. 152. № 4. С. 169-178. 22. Сравнительная оценка in vitro эффективности метабиотической и мета-пробиотической композиций, перспективных для применения в птицеводстве/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин, А.С. Мухаммадиева, А.П. Глинушкин// Актуальные вопросы совершенствования технологии производства и переработки продукции сельского хозяйства: материалы международной научно-практической конференции. Йошкар-Ола: Марийский государственный университет, 2023. С. 813-816. 23. Сравнительная экспериментальная оценка эффективности современных пробиотиков, пребиотиков, синбиотиков и метабиотиков при коррекции нарушений микробиоценоза кишечника у животных с антибиотико-ассоциированным дисбиозом/ И.Ю. Чичерин, И.П. Погорельский, И.Г. Лундовских, И.В. Дармов, М.Р. Шабалина, А.С. Подволоцкий// Экспериментальная и клиническая гастроэнтерология. 2016. № 7. С. 106-120. 24. Стоянова Л.Г., Устюгова Е.А., Нетрусов А.И. Антимикробные метаболиты молочнокислых бактерий: разнообразие и свойства (обзор)// Прикладная биохимия и микробиология. 2012. Т. 48. № 3. С. 259-275. 25. Технология приготовления жидкой формы ветеринарного пробиотического препарата на основе штамма Lactobacillus paracasei/ Н.В. Позолотина, И.В. Дармов, И.В. Маракулин, И.П. Погорельский// Фундаментальные исследования. 2015. № 2-10. С. 2164-2169. 26. Ферментативная активность ксиланаз и целлюлаз пробиотических штаммов Bacillus subtilis/ Р.С. Мухаммадиев, Р.С. Мухаммадиев, Л.Р. Валиуллин, В.В. Бирюля, Е.В. Скворцов// Ветеринарный врач. 2019. № 3. С. 19-23. 27. Avdeeva L.V., Osadchaya A.I., Kharhota M.A. Biosynthesis of cellulases by probiotic strains Bacillus subtilis at joint cultivation// Microbiology and biotechnology. 2010. 4(12). 80-89. DOI:10.18524/2307-4663.2010.4(12).97487. 28. Bacillus subtilis M6 improves intestinal barrier, antioxidant capacity and gut microbial composition in AA broiler/ L. Ji, L. Zhang, H. Liu, J. Shen, Y. Zhang, L. Lu, X. Zhang, X. Ma// Front. Nutr. 2022. 9. 965310. DOI: 10.3389/fnut.2022.965310. 29. Comparative efficacy of postbiotic, probiotic, and antibiotic against necrotic enteritis in broiler chickens/ W.A. Abd El-Ghany, M.A. Abdel-Latif, F. Hosny, N.M. Alatfeehy, A.E. Noreldin, R.R. Quesnell, R. Chapman, L. Sakai, A.R. Elbestawy// Poult. Sci. 2022. 101(8). 101988. DOI: 10.1016/j.psj.2022.101988. 30. Effective bifidogenic growth factors cyclo-Val-Leu and cyclo-Val-Ile produced by Bacillus subtilis C-3102 in the human colonic microbiota model/ M. Hatanaka, H. Morita, Y. Aoyagi, K. Sasaki, D. Sasaki, A. Kondo, T. Nakamura// Sci. Rep. 2020. 10(1). 7591-7600. DOI:10.1038/s41598-020-64374-w. 31. Effects of dietary supplementation with Bacillus subtilis, as an alternative to antibiotics, on growth performance, serum immunity, and intestinal health in broiler chickens/ K. Qiu, C.L. Li, J. Wang, G.H. Qi, J. Gao, H.J. Zhang, S.G. Wu// Front. Nutr. 2021. 8. 786878. DOI: 10.3389/fnut.2021.786878. 32. Encapsulation of beneficial probiotic bacteria in extracellular matrix from biofilm-forming Bacillus subtilis/ S. Yahav, Z. Berkovich, I. Ostrov, R. Reifen, M. Shemesh// Artif. Cells Nanomed. Biotechnol. 2018. 46. 974-982. DOI: 10.1080/21691401.2018.1476373. 33. Evaluation of probiotic and prebiotic-like effects of Bacillus subtilis BN on growth of lactobacilli/ M. Horie, T. Koike, S. Sugino, A. Umeno, Y. Yoshida// J. Gen. Appl. Microbiol. 2018. 64(1). 26-33. DOI: 10.2323/jgam.2017.03.002. 34. Improved growth and viability of lactobacilli in the presence of Bacillus subtilis (natto), catalase, or subtilisin/ T. Hosoi, A. Ametani, K. Kiuchi, S. Kaminogawa// Can. J. Microbiol. 2000. 46(10). 892-897. DOI: 10.1139/w00-070 35. In vitro and in silico assessment of probiotic and functional properties of Bacillus subtilis DE111®/ S. Mazhar, E. Khokhlova, J. Colom, A. Simon, J. Deaton, K. Rea// Front. Microbiol. 2023. 13. 1101144. DOI: 10.3389/fmicb.2022.1101144. 36. Kharkhota M.A., Osadchaia A.I., Avdeeva L.V. Growth peculiarities of probiotic strains of Bacillus subtilis at their joint cultivation in deep conditions. Mikrobiol. Z. 2011. 73(6). 25-31. 37. Kimelman H., Shemesh M. Probiotic bifunctionality of Bacillus subtilis-rescuing lactic acid bacteria from desiccation and antagonizing pathogenic Staphylococcus aureus// Microorganisms. 2019. 7(10). 407-423. DOI: 10.3390/ microorganisms7100407. 38. Lacticaseibacillus rhamnosus reduces the pathogenicity of escherichia coli in chickens/ M. Guo, C. Zhang, C. Zhang, X. Zhang, Y. Wu// Front. Microbiol. 2021. 12. 664604. DOI: 10.3389/fmicb.2021.664604. 39. Lee N.K., Kim W.S., Paik H.D. Bacillus strains as human probiotics: characterization, safety, microbiome, and probiotic carrier// Food Sci. Biotechnol. 2019. 28(5). 1297-1305. DOI: 10.1007/s10068-019-00691-9. 40. Mazkour S., Shekarforoush S., Basiri S. The effects of supplementation of Bacillus subtilis and Bacillus coagulans spores on the intestinal microflora and growth performance in rat// Iran. J. Microbiol. 2019. 11(3). 260-266. 41. New crosstalk between probiotics Lactobacillus plantarum and Bacillus subtilis/ T. Yu, J. Kong, L. Zhang, X. Gu, M. Wang, T. Guo// Sci. Rep. 2019. 9(1). 13151-13160. DOI:10.1038/s41598-019-49688-8. 42. Production of the postharvest biocontrol agent Bacillus subtilis CPA-8 using low cost commercial products and by-products/ Yanez-Mendizabal V., Vinas I., Usall J., Torres R., Solsona C., N. Teixido// Biological Control. 60 (3). 280-289. DOI: 10.1016/j.biocontrol.2011.12.001. Резюме. В работе представлены результаты исследований по оптимизации параметров совместного культивирования штаммов B. subtilis GA27 и B. subtilis RF-45. Установлено, что наибольшее накопление биомассы исследуемых бациллярных штаммов, соответствующее максимальному антагонистическому их действию в отношении возбудителей кишечных инфекций молодняка сельскохозяйственной птицы, обеспечивается на соевой среде с добавлением 0,5% пшеничных отрубей при температуре 35°С, активной кислотности среды 6,5, скорости вращения качалки 180 об./мин, продолжительности процесса совместного глубинного их культивирования 16 ч. В качестве посевного материала при этом необходимо использовать стационарные культуры с общим титром не менее (6,12±0,17)x106 КОЕ/мл и вносить его в количестве 10% от объема среды для роста. Оптимальное соотношение посевной концентрации B. subtilis GA27 и B. subtilis RF-45 - 1:2. Полученные после совместного культивирования бацилл клеточная суспензия, культуральная жидкость и супернатант характеризовались способностью к коррекции кишечной микробиоты крыс линии Wistar с гентами-цин-индуцированным дисбиозом. По сравнению с клеточной суспензией и культуральным супернатантом бактериальной ассоциации культуральная жидкость последней обладала наиболее высокой скоростью восстановления микробиоты кишечника животных. Под влиянием культуральной жидкости бациллярного консорциума скорость восстановления общей численности кишечных микроорганизмов относительно аналогичного показателя опытных групп животных, получавших ее культуральный супернатант и клеточную суспензию, была выше соответственно в 1,12 и 8,35 раз, количества молочнокислых бактерий - соответственно в 1,04 и 13,03 раза. По скорости восстановления бактерий группы кишечной палочки клеточная суспензия, культуральная жидкость и супернатант ассоциации B. subtilis GA27 и B. subtilis RF-45 превосходили в 22-245 раз указанный показатель контрольной группы животных, при этом наиболее эффективным в этом плане был культуральный супернатант бактериального консорциума. Ключевые слова: Bacillus subtilis, биосовместимые штаммы, совместное выращивание, оптимизация, антимикробный потенциал, коррекция микроэко-логических нарушений кишечника, эффективность, пробиотики, метапробиотики, метабиотики, птицеводство Сведения об авторах: Мухаммадиев Ринат Салаватович, кандидат биологических наук, научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; научный сотрудник сектора пробиотических препаратов и ферментов ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-987-4214127; е-mail: tanirtashir@mail.ru. Валиуллин Ленар Рашитович, кандидат биологических наук, старший научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; заведующий лабораторией кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-950-9698469; е-mail: valiullin27@mail.ru. Барышев Михаил Геннадьевич, доктор биологических наук, профессор, профессор РАН, и.о. директора ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; 143050, Московская обл., Одинцовский р-н, р. п. Большие Вяземы, ул. Институт, вл. 5; тел.: 8-495-5974228; е-mail: vniif@vniif.ru. Яруллин Айнур Ильнурович, кандидат биологических наук, старший научный сотрудник, заведующий отделения вирусологических и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-905-3174170; е-mail: abii@mail.ru. Дуплева Лилия Шамиловна, кандидат биологических наук, старший научный сотрудник отдела бактериологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности», 420075, г. Казань, ул. Научный городок-2; тел.: 8-917-2782737; е-mail: dupleva.lilya@mail.ru. Каримуллина Ильсияр Габделгазизовна, кандидат биологических наук, старший научный сотрудник отдела вирусных и ультраструктурных исследований ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-904-7699225; е-mail: 89047699225@mail.ru. Тимербаева Разалия Рустамовна, кандидат ветеринарных наук, доцент кафедры эпизоотологии и паразитологии ФГБОУ ВО «Казанская государственная академия ветеринарной медицины имени Н.Э.Баумана»; 420029, г. Казань, ул. Сибирский Тракт, 35; тел. 8-903-3401420; е-mail: 8-903-3401420@mail.ru. Ответственный за переписку с редакцией: Мухаммадиев Ришат Салаватович, кандидат биологических наук, научный сотрудник лаборатории прикладной и экспериментальной микробиологии ФГБНУ «Всероссийский научно-исследовательский институт фитопатологии»; научный сотрудник лаборатории кормов и кормовых добавок ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности»; 420075, г. Казань, ул. Научный городок-2; тел.: 8-939-3728789; e-mail: tashir9891@mail.ru.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|