|
||||

Опыт изготовления и применения инактивированной вакцины против некробактериоза животныхУДК 619:616.98:579.844 Сущих В.Ю., Каримов А.А., Канатов Б., Юсупов М.Р. ТОО «Казахский научноисследовательский Казахстан является аграрной республикой с развитым сектором животноводства и овцеводства. В последние годы в различные регионы республики были завезены тысячи голов высокопродуктивных коров молочного направления. Почти во всех хозяйствах с импортным скотом в настоящее время отмечаются болезни конечностей, в том числе и некробактериоз. При этом, заболеваемость конечностей, преимущественно некро-бактериозом, у ввозимого скота занимает одно из лидирующих мест среди остальных патологий. К числу болезней, имеющих в последние годы возрастающее значение и представляющих важную в практическом отношении проблему для животноводства, в первую очередь следует отнести некробактериоз. Так, среди группы болезней инфекционной патологии по заболеваемости и падежу он занимает II-III место, что дает полное основание считать данную болезнь одним из факторов, сдерживающих повышение рентабельности сельскохозяйственной отрасли [4]. Как правило, все мероприятия для ликвидации некробактериоза направлены на комплекс терапевтических и профилактических мероприятий. При этом вакцинация животных является одним из основных методов специфической профилактики. Несмотря на противоречивые точки зрения об иммунитете при некробактериозе и иммуногенности существующих вакцин, результаты производственных испытаний многих авторов свидетельствуют: вакцинация животных - важное звено в профилактике этого заболевания [3, 5] Профилактические меры с использованием вакцины против некро-бактериоза приобретают особое значение при ввозе импортного поголовья, особенно крупного рогатого скота [1, 2]. Однако информация по изготовлению и применению вакцины против некробактериоза для лошадей в литературных источниках отсутствует. В ТОО «КазНИВИ» обратился фермер из г. Алтай Зыряновского района Восточно-Казахстанской области с просьбой провести диагностику и возможную специфическую профилактику хромоты у имеющихся у него 440 голов лошадей. Для проведения клинического осмотра, диагностики и отбора проб биоматериала специалистами института был осуществлен выезд в КХ «Беловодье» Зыряновского района Восточно-Казахстанской области. Целью исследований являлась диагностика и разработка препарата для специфической профилактики некробактериоза у лошадей. Материалы и методы исследований. В процессе осмотра установлено, что в хозяйстве содержится 440 голов лошадей, в том числе: 230 голов орловской и 210 породы тяжеловозов. Все животные в теплые периоды года находятся на свободном выпасе в предгорье, а в зимние месяцы - в открытых загонах. В процессе работы проведено клиническое обследование всего поголовья животных. Больные животные, то есть с признаками хромоты были помещены в отдельный загон, где были тщательно осмотрены с использованием передвижного станка для фиксации. От всех хромых лошадей отбор проб патологического материала проводили на границе здоровой и пораженной ткани больной конечности. Определение видовой принадлежности бактерий проводили по морфологическим, тинкториальным, биохимическим и серологическим свойствам, согласно общепринятым методам. Посевной материал вносили в пробирки и флаконы с предварительно регенерированными средами в объеме 0,2%, которые помещали в термостат при температуре 37°С на 24-48 часов. Патогенность выделенных культур изучали на лабораторных животных (белых мышах) путем подкожного введения в область корня хвоста суточной бульонной культуры возбудителя в объеме 0,5 см3. Для получения максимального количества бактериальной массы, использовали питательную среду, приготовленную на основе панкреатических и кислотных гидролизатов мяса, казеина, печени, предназначенную для выращивания анаэробных микроорганизмов. Концентрацию бактериальной массы определяли по паратифозному стандарту мутности ГИСК им. Тарасевича. В лабораторных условиях проводили контроль основных качественных показателей опытной вакцины, а именно: стерильность, рН, безвредность, реактогенность и иммуногенную активность. Производственные испытания проводили на лошадях исследуемого хозяйства. Вакцину вводили подкожно в среднюю треть шеи в объеме 5,0 см3. Контроль опыта составляли аналогичные животные (20 голов), которым вакцинный препарат не вводился. Наблюдение за вакцинированными и контрольными животными вели в течение 10 месяцев. Статистическую обработку результатов исследований проводили, используя программу Microsoft Excel. Результаты и их обсуждение. Клинический осмотр всего поголовья лошадей в КХ «Беловодье» показал, что из 440 голов признаки хромоты установлены у 36 животных или 8,2%. При этом наибольшее количество хромых животных отмечено среди кобыл и конематок - 34 головы или 94,4% от всех больных. От всех хромых животных отобраны пробы биоматериала на границе здоровой и пораженной ткани конечности, всего получено 122 образца (рисунок 1).
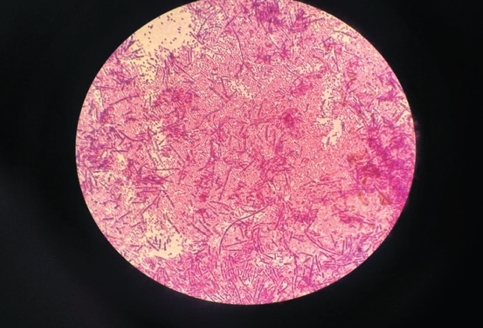
Рис. 1. Забор материала от пораженной конечности лошади Все пробы доставлены в лабораторию бактериологии института, где на основании микробиологических исследований были выделены и отобраны наиболее перспективные культуры возбудителей некробакте-риоза (16 изолятов) и проведено дальнейшее их подробное изучение. Все изучаемые культуры микроорганизмов культивировали на мясопептонном печеночном бульоне под вазелиновым маслом (первичные посевы) и далее на среде из панкреатических гидролизатов казеина, вываренного мясного фарша и дрожжей. Рост выделенных культур Fus. necrophorum наблюдали через 18-24 часа инкубации, во всех случаях отмечали помутнение среды и обильное газообразование. При микроскопии мазков из патологического материал, взятой на границе здоровой и некротизированной тканей, возбудитель Fus. necrophorum имел вид грамотрицательных, а при окраске синью Леффлера - зернистоокрашенных нитей различной длины. Следует отметить, что при установлении диагноза на некробакте-риоз при поражении копытец у всех животных наблюдалась ассоциация микроорганизмов в 100% случаях. При этом из гнойно-некротических очагов выделяли как аэробные, так и анаэробные культуры микроорганизмов. В молодой культуре некрофорума длина нитей достигала до 100 мкм, а толщина до 1 мкм. Старые культуры имели полиморфные формы (более короткие) и окрашивались также отрицательно по Граму (рисунок 2).
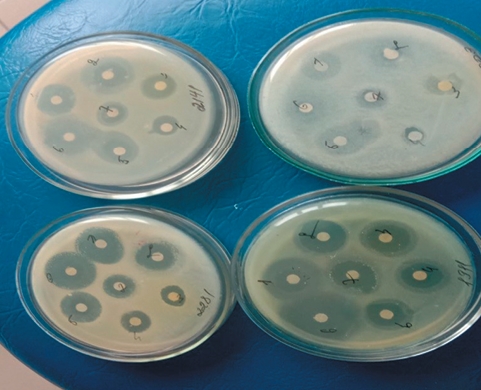
Рис. 2. Чистая бульонная культура Fus. necrophorum Проведены опыты по изучению чувствительности выделенных культур - основного возбудителя и сопутствующих, к различным антимикробным препаратам. При этом установлено, что наибольшей активностью обладали такие препараты как: нитокс, амоксициклин, азитронит и левомицетин, менее чувствительны, выделенные культуры были к тилозину и энрофлону и не установлено бактерицидного действия к бензилпеннициллину (рисунок 3).
Рис. 3. Определение чувствительности выделенных культур к антимикробным препаратам Для изготовления инактивированной вакцины против некробак-териоза были использованы наиболее иммуногенные эпизоотические культуры, выделенные от лошадей данного хозяйства. Технологический цикл изготовления вакцины против некробакте-риоза состоял из следующих этапов: получение I-ой, II-ой и III генерации культуры Fus. necrophorum, сорбцию, декантирование и розлив (фасовку) препарата. Контроль полученного препарата на основные качественные показатели проводили в лабораторных условиях. Так, образцы вакцины из 5 флаконов исследовали на стерильность путем её высева в пробирки на МПА, МПБ, Чапека (Сабуро) и МППБ под вазелиновым маслом и во флаконы с питательной средой МПБ и МППБ под вазелиновым маслом. Все посевы инкубировали в течение 10 суток в условиях термостата при температуре от +25 до +37 ± 0,1%°С. По истечении указанного срока, провели пересевы первичных посевов во флаконы с теми же средами. Наблюдения за первичными посевами вели 20 суток, а за пересевами 10 суток. По истечении указанного срока все посевы оставались стерильными, то есть все пробы опытной вакцины являются стерильными. Безвредность вакцины определяли в опыте на лабораторных животных. Препарат вводили подкожно трем клинически здоровым кроликам и трем клинически здоровым морским свинкам по 4,0 см3 и по 1,0 см3, соответственно. За животными вели наблюдение в течение 10 суток. В течение указанного срока все опытные животные оставались живыми и клинически здоровыми, на месте введения не было отмечено патологических изменений (отечность, болезненность, припухлость и др.), то есть все образцы препарата являются безвредными. Реактогенность опытной вакцины проверяли на десяти клинически здоровых морских свинках, которых иммунизировали подкожно в область мышц живота в дозе 0,5 см3 и одновременно на десяти белых мышах, которым препарат вводили внутрибрюшинно в объеме 0,2 см3. Исследования показали, у 2 морских свинок, иммунизированных вакциной, на месте инъекции отмечали образование незначительных отеков, которые постепенно исчезали в течение 3-5 суток. При этом введение вакцины не вызывало гибели морских свинок и белых мышей, то есть вакцина является безвредной и аректогенной. Определение концентрации водородных ионов (рН) показало, что данный показатель у препарата соответствовал 7,2. Таким образом, проведенные исследования показали, что опытная вакцина против некробактериза животных является безвредным, ареактогенным препаратом, отвечающим всем требованиям, необходимым для иммуногенных препаратов. Одним из основных критериев качества вакцинного препарата является его антигенная активность и профилактическая эффективность. В качестве лабораторного контроля антигенной активности вакцины против некробактериоза успешно использован метод определения антител в реакции агглютинации (РА) у вакцинированных кроликов. Для данного опыта была сформирована группа из 10 опытных кроликов массой 2,0-2,5 кг. Всех животных вакцинировали подкожно в дозе 2,0 см3. Контролем опыта служили не вакцинированные кролики в количестве 5 голов. Через 15 суток от всех животных взяли кровь и получили сыворотки, которые были в дальнейшем исследованы на наличие агглютинирующих антител в реакции агглютинации. В качестве антигена была использована подготовленная и оттитрованная культура Fus. necrophorum. Результаты исследований показали, что при введении вакцины средние титры антител у опытных кроликов составляли 1:32±2,1. У контрольных животных антитела не установлены. Полученные результаты свидетельствует о высокой иммуногенной активности вакцины. Также, дополнительно всем иммунизированным и контрольным животным была введена оттитрованная вирулентная культура Fus. necrophorum в объеме по 0,5 см3 подкожно (заражающая доза LD100). Наблюдения за всеми кроликами после введения вирулентной культуры вели в течение 30 суток. Опыты показали, что все иммунизированные животные в течение всего срока наблюдения оставались живыми и признаков заболевания некробактериозом, отмечено не было. В контрольной группе через 8-12 суток отмечали заболевание животных, а через 14-16 суток их гибель. После успешных лабораторных испытаний опытная вакцина была апробирована в производственных условиях. Предварительно перед массовой иммунизацией было завакцинировано 10 лошадей, за которыми вели наблюдения в течение 10 суток. При этом установлено, что местных и общих изменений физиологического состояния у опытных животных не отмечено. После чего, вакцина была введена остальным 382 клинически здоровым лошадям. Всем животным вакцину вводили подкожно в среднюю треть шеи в дозе 5,0 см3. Наблюдение за иммунизированными животными вели в течение 10 суток, при этом установлено, что опытная вакцина является безвредным и слабореактогенным препаратом. Так у вакцинированных животных не отмечали повышения общей температуры тела, однако у 6 кобыл на месте введения наблюдали болезненную припухлость диаметром 3-4 см, исчезающую на 4-5-е сутки, что свидетельствует о наличии слабой реактогенности препарата. Через 30 суток провели повторную вакцинацию лошадей в аналогичной дозе. Через 1 и 6 месяцев после последнего введения опытной вакцины, выборочно у 41 животного взяли кровь для контроля иммуногенной эффективности опытной вакцины. Определение данного показателя проводили, также как и при лабораторном контроле вакцин, а именно по обнаружению агглютинирующих титров антител в реакции агглютинации. Исследования показали, что через 30 суток после вакцинации средние титры антител составляли log2- 1,68±0,14, а через 6 месяцев - log- 1,46±0,22. В процессе клинического наблюдения за животными в течение 10 месяцев после вакцинации установлено 3 лошади (0,7%) с признаками хромоты. При этом, со слов руководителя хозяйства, за указанные периоды до вакцинации с аналогичной клинической картиной выявлялось от 35 (8%) до 73 голов (16,6%), то есть заболеваемость животных некробактериозом снизилась более чем в 11 раз. Следует отметить, что в период всего эксперимента осложнений или нежелательных явлений у опытных животных отмечено не было. Заключение. Таким образом, применение вакцины против некробактериоза жидкой инактивированной в опыте на лошадях показали её высокую эффективность и целесообразность. Кроме того, расчеты экономического эффекта при применении опытной вакцины, включающие предотвращение затрат на терапевтические мероприятия, предотвращенного вынужденного забоя, показали, что он составляет в пересчете на 1 голову - 46 010 тенге, а окупаемость ветеринарных мероприятий - 38,16 тенге на 1 тенге затрат (что эквивалентно 7 570,52 российских рублей, а окупаемость ветеринарных мероприятий - 6,28 российских рублей на 1 рубль затрат). Список литературы: 1. Гулюкин, М. И. Комплексная система мероприятий при некробактерио-зе животных / М. И. Гулюкин // Ветеринария. - 2007. - № 9. - С. 5-8. 2. Караваев, Ю. Д. Комплексная система мероприятий при некробакте-риозе животных / Ю. Д. Караваев // Ветеринария. - 2007. - № 9. - С. 19-23. 3. Лопатин, С. В. Оптимизация системы контроля эпизоотического процесса некробактериоза крупного рогатого скота: дис. на соиск. учен. степ. докт. вет. наук : 16.00.03, 16.00.04 / Лопатин Сергей Викторович ; Инст. эксперимент. ветеринарии Сибири и Дальнего Востока. - Новосибирск, 2006. - 311 с. 4. Разработка и испытание инактивированной вакцины против некробак-териоза животных на базе ТОО «Байсерке-Агро» / Н. П. Иванов, В. Ю. Сущих, Б. Канатов, Н. Н. Егорова, А. Розямов //GLOBAL SCIENCE AND INNOVATION. -2020. - С. 287-292. 5. Соломаха, О. И. Некробактериоз - комплексное решение проблемы / О. И. Соломаха // Аграрная Россия. - 2001. - № 3. - С. 38-42. Резюме. В статье приведены данные по экспериментальной разработке и применению вакцины против некробактериоза лошадей. Проблема не-кробактериозной инфекции в Казахстане имеет широкое распространение среди крупного и мелкого рогатого скота. Однако, данных по заболеваемости и специфической профилактики данной инфекции среди лошадей не установлено. В крестьянском хозяйстве Восточно-Казахстанской области на протяжении ряда лет регистрировали хромоту у лошадей. В весенне-осенний периоды заболеваемость животных составляла от 8% до 16,6%. Авторами проведен клинический осмотр всего поголовья и от больных лошадей отобраны пробы биоматериала. Из образцов, доставленных в условия лаборатории, выделен возбудитель Fus. necrophorum. После изучения основных культурально-морфологических и биологических свойств у выделенных культур были отобраны наиболее перспективные из них. Данные микроорганизмы в дальнейшем были использованы для получения антигенов. По общепринятой схеме была изготовлена опытная серия инактивированной вакцины против некробактери-оза лошадей. В лабораторных условиях вакцинный препарат был проверен на основные качественные показатели - безвредность, реактогенность, концентрацию водородных ионов, стерильность и иммуногенную активность. После получения положительных результатов вакцина была апробирована в производственных условиях на клинически здоровых лошадях данного хозяйства. Животных иммунизировали в дозе 5,0 см3 дважды с интервалом 30 суток. Через 1 и 6 месяцев после последнего введения препарата, выборочно от животных была отобрана кровь для контроля иммуногенной эффективности опытной вакцины. Серологические исследования показали, что через 1 месяц после вакцинации средние титры агглютинирующих антител у животных составляли log2- 1,68±0,14, а через 6 месяцев log2- 1,46±0,22. Клиническое наблюдение за лошадьми в течение 10 месяцев после вакцинации показало, что заболеваемость животных некробактериозом снизилась более чем в 11 раз. Ключевые слова: некробактериоз, лошади, вакцина, иммунизация, титр, антитела, эффективность, иммуногенная активность, безвредность, заболеваемость. Сведения об авторах: Каримов Абдилкарим Абрахманович, научный сотрудник ТОО «Казахский научно-исследовательский ветеринарный институт»; 050016, Республика Казахстан, г. Алматы, проспект Райымбека, 223; тел.: 8-777-3304231; e-mail: aben66@mail.ru. Канатов Бегали, кандидат ветеринарных наук, старший научный сотрудник отдела эпизоотологического мониторинга и оценки рисков бактериальных болезней животных ТОО «Казахский научно-исследовательский ветеринарный институт»; 050016, Республика Казахстан, г. Алматы, проспект Райымбека, 223; тел.: 8-776-7385186; e-mail: kanat_bek59@mail.ru. Юсупов Малик Реимжанович, научный сотрудник ТОО «Казахский научно-исследовательский ветеринарный институт»; 050016, Республика Казахстан, г. Алматы, проспект Райымбека, 223; тел.: 8-707-2325005; e-mail: malik_imhana@mail.ru. Дюсенов Сайран Мырзаханович, кандидат ветеринарных наук, заведующий «Карагандинская научно-исследовательская ветеринарная станция»; 100000, Республика Казахстан, г. Караганда, Западная промзона, 47; тел.: 8-701-6393574; e-mail: kar_nivs@mail.ru. Ответственный за переписку с редакцией: Сущих Владислава Юрьевна, кандидат ветеринарных наук, заведующий отделом эпизоотологического мониторинга и оценки рисков бактериальных болезней животных ТОО «Казахский научно-исследовательский ветеринарный институт»; 050016, Республика Казахстан, г. Алматы, проспект Райымбека, 223; e-mail: vladasali@mail.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|