|
||||

Оценка противовирусной активности синтетических соединений с антимикробными свойствамиУДК615.2818 Нечаева О.В., Тихомирова Е.И. ФГБОУ ВО «Саратовский государственный технический университет имени Гагарина Ю.А.», г. Саратов Введение. Проблема лечения инфекционных заболеваний, в том числе и вирусной этиологии, в настоящее время сохраняет свою актуальность. И, хотя, в последние десятилетия наблюдается прогресс в борьбе с возбудителями вирусных инфекций человека и животных с помощью химиотерапевтических препаратов, однако по эффективности он значительно уступает антибактериальной терапии [15]. Сложность получения противовирусных препаратов связана с облигатным внутриклеточным паразитизмом возбудителей, влиянием на энергетические и метаболические процессы клетки и интеграции вирусного генома и генома хозяина [2, 7]. С этим связано цитотоксическое действие большинства противовирусных препаратов [12, 20].
По механизму действия многие противовирусные препараты являются индукторами эндогенного интерферона [2, 7]. Наибольший интерес представляют противовирусные средства, ингибирующие процессы адсорбции, проникновения и депротеинизации вирусной частицы в чувствительных клетках, например, препараты группы ада-мантана, а также подавляющие процесс синтеза ранних вирусных белков, например, гуанидин.
Огромным достижением в лечении вирусных инфекций стало создание аномальных нуклеотидов, которые представляют собой структурные аналоги пуриновых и пиримидиновых оснований и подавляют процесс синтеза нуклеиновых кислот, ингибируя вирусные полимеразы [5, 18, 21]. Эффективными также являются химиопрепараты - ингибиторы вирусной нейраминидазы, например, озельтамивир [1, 4].
Однако применение современных противовирусных средств приводит к быстрому формированию устойчивости вирусов, механизмы которой связаны с мутациями в генах, которые кодируют ферменты, принимающие участие в метаболизме препаратов, или сами являются мишенью действия противовирусных препаратов [15]. Кроме того, большинство противовирусных средств характеризуются высокой токсичностью, что ограничивает их использование. Поэтому поиск новых синтетических соединений, обладающих противовирусной активностью, является актуальным.
Перспективным в этом направлении является поиск гетероциклических соединений, обладающих противовирусной активностью. Например, производные адамантана в экспериментах на культуре клеток характеризовались вирусингибирующими свойствами в отношении вируса осповакцины [6]. 1,4-Бис(1-адамантил)-1,4-бутандиол обладал способностью подавлять размножение вируса осповакцины в концентрации 0.75 мкг/мл, при этом индекс селективности составил ~ 133.3. Кроме того, вирусингибирующее действие 1,4-бис (1-адамантил)-1,4-бутандиола проявлялось на культуре клеток Vero в отношении вируса оспы коров (штамм Гришак) и вируса оспы мышей (штамм К-1).
В связи с актуальностью изложенных вопросов целью исследования явилось изучение противовирусной активности синтетических соединений с антимикробными свойствами из ряда фенилпентендио-на и полимерного соединения.
Материалы и методы исследования. Использовали соединение ряда фенилпентендиона - 2,4-дихлор-1,3,5-трифенил-2-пентен-1,5-дион (ПНВ-1) и полимерное соединение - полиазолидинаммоний, модифицированный гидрат-ионами йода (ПААГ-М), для которых в предыдущих исследованиях показан широкий спектр антимикробной активности [9, 11, 14]. Кроме того, по показателям острой токсичности на биотест-объектах и лабораторных животных ПНВ-1 относится к III, а ПААГ-М - к IV классу токсичности [8, 10].
Противовирусную активность соединений изучали в отношении авирулентного штамма «ВН-96» вируса трансмиссивного гастроэнтерита свиней (ТГЭС) из лаборатории вирусных инфекций ГНУ «Саратовский НИВИ».
В качестве клеточной культуры использовали трофовариант перевиваемой линии клеток (ПЛК) почки эмбриона свиньи - СПЭВ-б.
Монослойную культуру линии клеток СПЭВ-б выращивали в стационарных условиях в пластиковых чашках Петри (d=40 мм), в течение 3-5 суток при температуре 37±0,5°С. Рост клеток в культуре и формирование монослоя контролировали под малым увеличением микроскопа. Монослойная культура была представлена в основном мелкозернистыми, прозрачными, эпителиоподобными клетками. При проведении экспериментальных исследований в каждом опыте оценивали особенности морфологии клеток монослоя [3, 13]. Исходный рост чистой культуры линии клеток считали контролем 1.
Для получения клеточного монослоя, зараженного вирусом ТГЭС (контроль 2), использовали посевную концентрацию клеток 150 тыс/мл с нормальной морфологией и жизнеспособностью не менее 95%. Доза заражения и сроки максимального накопления вируса ТГЭС (штамм «ВН-96») установлены ранее [16].
Заражение клеточных культур осуществляли штаммом «ВН-96» вируса ТГЭС в суспензию клеток СПЭВ-б из расчета 5,0 lg средней тканевой цитопатической дозы (ТЦД50) на мл среды. Адсорбцию вируса на клетках проводили в течение 60 минут, после чего вносили 2% эмбриональную сыворотку кролика и для формирования монослоя зараженных клеток помещали в чашки Петри. Культуры клеток инкубировали в стационарных условиях в течение 5-6 суток при температуре 37°С.
Противовирусную активность исследуемых соединений оценивали по методу Мовлеса [19]. Для этого препараты вносили в субтоксической дозе в рабочую суспензию клеток после адсорбции вируса с последующим формированием монослоя. Расчет субтоксической дозы исследуемых соединений проводили по методу Рида и Менча [17]. Оценку противовирусного действия препарата проводили путем изучения морфологических особенностей клеточного монослоя с помощью цифровой камеры-окуляра для микроскопа SCOPETEK® DCM 35 каждые 24 часа.
Результаты исследований и их обсуждение. На начальном этапе работы были определены субтоксические концентрации исследуемых препаратов, не вызывающих цитопатического действия на культуру клеток СПЭВ-б, которые, согласно полученным результатам, для ПНВ-1 и ПААГ-М составили 1 мкг/мл.
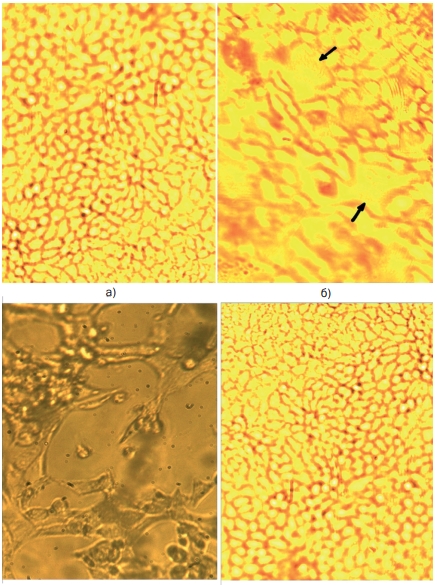
На рисунке 1 а представлена фотография морфологических особенностей монослоя культуры клеток СПЭВ-б. Клетки СПЭВ-б имели по тесту витального окрашивания трипановым синим жизнеспособность на уровне 82-86%. На вторые сутки культивирования отмечался островковый рост эпителиоподобных клеток полигональной формы. Клетки имели четко выраженные границы с хорошо окрашенной цитоплазмой, в которой располагались крупные сферической формы вакуоли. Ядра клеток были крупные, овальные, содержали 2-3, реже 5 ядрышек правильной округлой формы. Монослой клеток в контроле полностью формировался на третьи сутки культивирования в стационарных условиях.
Для оценки воздействия вируса на клетки оценивали морфологические изменения культуры клеток СПЭВ-б. На рисунке 1 б представлена фотография монослоя, зараженного вирусом ТГЭС. На третьи сутки культивирования отмечалось цитопатическое действие вируса на клетки монослоя. В монослое происходили деструктивные изменения отдельных клеток: отмечалось возникновение округлых клеточных структур с зернистой цитоплазмой, часть которых дегенерировала с образованием «окон». В основном рисунок и границы клеток были слабо выражены, увеличивалось межклеточное пространство, клетки теряли митотическую активность.
Рис. 1. Морфология монослоя культуры клеток СПЭВ-б, увеличение х100: а - контроль; б - зараженного вирусом ТГЭС (разрушение клеток под действием вируса на 3-и сутки культивирования, появление «окон»); в - зараженного вирусом ТГЭС (разрушение клеток под действием вируса на 5 сутки); г - зараженного вирусом ТГЭС и обработанного ПНВ-1 (5-е сутки эксперимента) На пятые сутки культивирования происходили дальнейшие изменения в структуре клеточного монослоя: в поле зрения появлялись
округлые апоптозные тельца, происходило отслоение клеточного монослоя от субстрата и на этом этапе исследования поражение клеток вирусом составляло 80-90 % (рисунок 1 в).
Оценку противовирусной активности сублетальных концентраций полимерного соединения ПААГ-М и препарата ряда фенилпентен-диона ПНВ-1 оценивали аналогично по основным морфологическим характеристикам клеток. Поскольку не было выявлено достоверных морфологических отличий клеток при воздействии исследуемых препаратов, на рисунке 1 г представлена фотография клеточного монослоя, обработанного препаратом ПНВ-1.
Было установлено, что клетки СПЭВ-б, обработанные ПНВ-1, обладали выраженными ростовыми свойствами и аналогично контрольной культуре клеток формирование монослоя начиналось уже на вторые сутки стационарного культивирования без признаков дегенерации клеток в культуре. Это свидетельствовало о чувствительности вируса ТГЭС к исследуемым препаратам и отсутствии процесса репродукции в обработанном клеточном монослое.
Заключение. Таким образом, в ходе проведенных исследований было установлено, что исследованный вирус ТГЭС чувствителен к действию сублетальных концентраций гетероциклического соединения ряда фенилпентендиона ПНВ-1 и биосовместимого полимера ПААГ-М. Низкие показатели токсичности исследуемых соединений позволяют рассматривать данные препараты в качестве перспективных противовирусных препаратов, а также в качестве дезинфицирующих и антисептических средств широкого спектра действия при дальнейшем более детальном исследовании их свойств.
Список литературы:
Резюме. Поиск новых препаратов для лечения инфекционных заболеваний вирусной этиологии является одной из актуальных задач современной ветеринарии и медицины. Помимо высокой эффективности противовирусные препараты должны быть безопасными в использовании и не оказывать негативного воздействия на макроорганизм. В статье приведены результаты исследования противовирусной активности гетероциклического соединения ряда фенилпен-тендиона - 2,4-дихлор-1,3,5-трифенил-2-пентен-1,5-диона и биосовместимого полимерного соединения - полиазолидинаммония, модифицированного гидрат-ионами йода. Выбор этих соединений был обусловлен их низким уровнем токсичности и широким спектром антимикробной активности. В качестве экспериментальной модели использовали штамм «ВН-96» вируса трансмиссивного гастроэнтерита свиней, который культивировали на перевиваемой линии клеток почки эмбриона свиньи. С использованием метода Рида и Менча были установлены субтоксические дозы исследуемых соединений, которые составили 1 мкг/мл. Опытные образцы культуры клеток предварительно обрабатывали рабочими концентрациями исследуемых соединений с последующим формированием монослоя. В ходе проведенных исследований было выявлено, что в контрольных образцах монослоя культуры клеток, зараженных вирусом, на третьи сутки культивирования происходили значительные деструктивные изменения клеток с отслоением их от субстрата к пятым суткам, когда поражение клеток вирусом составляло 80-90 %. Предварительная обработка культуры клеток субтоксическими концентрациями исследуемых соединений приводила к сохранению их ростовых свойств и исходных морфологических характеристик, а также отсутствию цитопатического действия вируса. Это свидетельствовало о высокой чувствительности вируса трансмиссивного гастроэнтерита свиней к действию исследуемых препаратов. Полученные результаты позволяют рассматривать исследуемые соединения в качестве перспективных противовирусных средств.
Ключевые слова: вирус трансмиссивного гастроэнтерита свиней, цитопатическое действие, противовирусная активность, антимикробные свойства, синтетические соединения, гетероциклические соединения ряда фенилпентендиона, биосовместимое полимерное соединение, субтоксические концентрации.
Сведения об авторах:
Тихомирова Елена Ивановна, доктор биологических наук, профессор, заведующая кафедрой «Экология» ФГБОУ ВО «Саратовский государственный технический университет имени Гагарина Ю.А.»; 410054, г. Саратов, ул. Политехническая, 77; тел.: 8-452-998530; e-mail: tichomirova_ei@mail.ru.
Ласкавый Владислав Николаевич, доктор ветеринарных наук, Заслуженный ветеринарный врач России, директор по науке ООО «Научно-исследовательский институт медико-ветеринарных биотехнологий»; 129515, г. Москва, ул. Академика Королева, д. 9, корп. 5; тел.: 8-915-1100167; e-mail: sarvlad47@bk.ru.
Кузнецова Анна Евгеньевна, кандидат биологических наук, старший научный сотрудник ООО «Научно-исследовательский институт медико-ветеринарных биотехнологий»; 129515, г. Москва, ул. Академика Королева, д. 9, корп. 5; тел.: 8-961-6420874; e-mail: shirokova-7575@mail.ru.
Вакараева Малика Мовсаровна, кандидат биологических наук, старший преподаватель кафедры нормальной и патологической физиологии Медицинского института ФГОУ ВО «Чеченский государственный университет»; 364907, Чеченская Республика, г. Грозный, ул. Шерипова, д. 32; тел.: 8-9389931011; e-mail: mvakaraeva@mail.ru.
Ответственный за переписку с редакцией: Нечаева Ольга Викторовна, кандидат биологических наук, доцент кафедры «Экология» ФГБОУ ВО «Саратовский государственный технический университет имени Гагарина Ю.А.»; 410054, г. Саратов, ул. Политехническая, 77; тел.: 8-9271081108; e-mail: olgav.nechaeva@rambler.ru.
|
| 2011 © Ветеринария Кубани | Разработка сайта - Интернет-Имидж | |
|---|---|---|